-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Учитель химии МБОУ «ВОШ №3 г.Пугачева
Саратовской области»
Подготовка
к ЕГЭ
Выполнение
заданий высокого уровня сложности, задачи на вывод формул
Для решения задач этого типа необходимо
знать общие формулы классов органических веществ и общие формулы для вычисления
молярной массы веществ этих классов.
Органические
вещества образуют гомологические ряды, которые имеют общие формулы.
Это позволяет:
·
выражать
молярную массу через число n
M(CnH2n
+ 2) = 12 ∙ n + 1 ∙ (2n +2) = 14n + 2;
·
приравнивать
молярную массу, выраженную через n, к истинной молярной массе и
находить n.
·
составлять
уравнения реакций в общем виде и производить по ним вычисления.
При решении таких
задач нужно знать и использовать общие формулы гомологических рядов:
1. алканы – СnH2n + 2
2. алкены и
циклоалканы – CnH2n
3. алкины и
алкадиены – CnH2n – 2
4. арены – CnH2n
– 6
5. моногалогеналканы
– CnH2n
+ 1Г
6. дигалогеналканы
– CnH2nГ2
7. фенолы – CnH2n
– 7OH
8. предельные
одноатомные спирты – CnH2n + 1OH, R – COH
9. альдегиды
– CnH2n + 1 COH, R – COH
10. предельные
карбоновые кислоты – CnH2n + 1COOH, R – COOH
11. сложные
эфиры – R1
– COOR2
12. первичные
амины – CnH2n + 1NH2, R – NH2
вторичные амины – R1 – NH – R2
третичные амины – R1 – N – R2
R3
14. аминокислоты – CnH2n(NH2)COOH
Формулы для нахождения молярной
массы:
— если известна плотность:
r = m / V = M / Vm Þ M = r ∙ Vm = r г/л ∙ 22,4 л/моль
— если известна масса и объём
газа, молярную массу можно найти двумя способами:
— через плотность r = m / V, M = r ∙ Vm;
— через количество вещества: n = V / Vm, M = m / n.
— если известна
относительная плотность первого газа по другому:
D21
= M1 / M2 Þ M1 = D2 ∙ M2
M = DH2 ∙ 2 M = DO2 ∙ 32
M
= Dвозд. ∙ 29
M = DN2 ∙ 28 и
т.д.
Задачи
на вывод формул органических соединений – это задания 35 КИМа ЕГЭ.
Максимальный
балл за это задание в 2018 году составил 3 балла.
При всём многообразии задач на вывод формул можно выделить несколько основных
типов. Рассмотрим алгоритмы решений этих задач наиболее простыми способами.
I. Вывод
формул веществ по массовым долям элементов.
1.
Написать
формулу вещества, обозначив индексы через x, y, z.
2.
Если
неизвестна массовая доля одного из элементов, то её находят, отняв от 100 %
известные массовые доли.
3. Найти
соотношение индексов, для этого массовую долю каждого элемента (лучше в %)
разделить на его атомную массу (округлить до тысячных долей) x : y: z = ω1 / Ar1 : ω2 / Ar2 : ω3 / Ar3
4. Полученные числа
привести к целым. Для этого разделить их на наименьшее из полученных чисел.
При необходимости (если опять получилось дробное число) после этого домножить
до целого числа на 2, 3, 4 … .
5. Получится
простейшая формула.
6. На основании
данных условия задачи составить структурную формулу исходного вещества
Задача №1.
Массовая доля углерода в углеводороде
составляет 85,71%. Данный углеводород вступает в реакцию гидратации, при этом
образуется соединение, молекулярная масса которого в 1,214 раз превышает массу
исходного углеводорода. Известно, что в молекуле углеводорода присутствуют
только первичные и третичные атомы углерода.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления
молекулярной формулы органического вещества и запишите молекулярную формулу
исходного органического вещества;
2) составьте структурную формулу этого вещества, которая
однозначно отражает порядок связи атомов в его молекуле;
3)
напишите уравнение реакции гидратации данного вещества.
Дано:
Решение:
ω(С) = 85,71 % 1) Напишем
формулу — СхНу
Найдём массовую долю водорода:
М.Ф. = ? ω(Н) = 100
% — 85,71 % = 14,29 %
Найдём
соотношение индексов:
х : у
= 85,71 / 12 : 14,29 / 1 = 7,14: 14,29 = 1 :2
Простейшая формула углеводорода– СН2,
но она не соответствует истинной.
Установим молекулярную формулу углеводорода.
Простейшей формуле– СН2 соответствует
общая формула СnH2n. (Это
алкен) .При гидратации образуется спирт с общей формулой СnH2n+2О. Тогда
1,214 ∙ (12n +2n)=12n+2n+2=16
n=6
Молекулярная формула — С6H12
2) Структурная формула:
СН3
│
СН3— С=С- СН3
(2,3- диметилбутен-2)
│
СН3
3) СН3
ОН СН3
│ │ │
СН3— С=С- СН3 +
Н2О → СН3— С — СН- СН3
│ │
СН3
СН3
II. Вывод формул
веществ по продуктам сгорания.
1. Проанализировать
состав продуктов сгорания и сделать вывод о качественном составе сгоревшего
вещества:
Н2О
® Н, СО2
® С, SO2 ® S, P2O5 ® P, Na2CO3 ® Na, C; HCl ® H, Cl
Наличие кислорода в веществе требует
проверки. Обозначить индексы в формуле через x, y, z.
Например: Сх Ну Оz .
2. Найти количества веществ продуктов
сгорания по формулам:
n = m / M и n = V / Vm
3. Найти количества элементов,
содержавшихся в сгоревшем веществе.
Например:
n(С) = n(СО2),
n(Н) = 2 ∙ n(Н2О),
n(Na) = 2 ∙ n(Na2CO3), n(C) = n(Na2CO3) и т.д.
4. Если сгорело
вещество неизвестного состава, то обязательно нужно проверить, содержался ли в
нём кислород. Например: Cx, Hy, Oz ,
m(O) = m в – ва – (m(C) + m(H)
Предварительно
нужно найти: m(C) = n(C) ∙ 12
г / моль,
m(H) = n(H) ∙ 1
г / моль
Если кислород
содержался, найти его количество: n(О) = m(O) / 16
г / моль
5. Найти
соотношения индексов по соотношению количеств элементов. Например:
x : y : z = n(С) : n(Н) : n(О)
Числа
привести к целым, разделив их наименьшее.
6. Если известны
данные для нахождения истинной молярной массы вещества, найти её по формулам: M = r ∙ Vm, M1 = D2 ∙ M2
7. Написать
простейшую формулу и найти её молярную массу. Сравнить истинную молярную массу
с простейшей и увеличить индексы в нужное число раз.
Задача №2
При сжигании образца некоторого
органического соединения массой 29,: г получено 70,4 г углекислого газа и 36,0
г воды.
Известно, что относительная плотность
паров этого вещества по воздуху равна 2,552. В ходе исследования химических
свойств этого вещества установлено, что при взаимодействии этого вещества с
оксидом меди(II)
образуется кетон.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления
молекулярной формулы органического вещества и запишите молекулярную формулу
исходного органического вещества;
2) составьте структурную формулу этого вещества, которая
однозначно отражает порядок связи атомов в его молекуле;
3)
напишите уравнение реакции этого вещества с оксидом меди(II).
|
Дано: m (в-ва) = 29,6 г m(CO2) = 70,4 m(Н2 О) = 36 г D(возд) |
Решение 1)Найдем количество вещества продуктов n(CO2)= 70,4/44=1,6 (моль); n(C)= 1,6 (моль) n(Н2 О)=36/18=2(моль); n(Н)= 2 ∙ m( О)=29,6-1,6 Найдем молекулярную массу Мr (в-ва) = D(возд) ∙ Мr(возд)=2,552∙29=74(г/моль) Найдем соотношения индексов по x : y : z = n(С) : n(Н) : n(О)=1,6:4: C4 H10O – простейшая формула Мr(C4 H10O)= 12 ∙4+10+16=74(г/моль), т.о. 2) Структурная формула: СН3-СН-СН2— СН3 │ ОН 3) СН3-СН-СН2— СН3 +CuO→ СН3-С-СН2— |
III. Вывод формул органических веществ по
общим формулам и по
химическим свойствам.
Рассмотрим возможные варианты задач
на вывод формул органических веществ по общим формулам и химическим свойствам.
Примеры задач, приведенных в этом разделе, являются лишь составной частью задач,
предлагаемых на ЕГЭ
1. Вывод
формул по известной массовой доле элемента в веществе.
Алгоритм решения:
1.
Написать
общую формулу и выразить молекулярную массу вещества через число n;
2.
Подставить
данные в формулу ω(Эл) = Аr (Эл) ∙ индекс / Мr;
3.
Решить
уравнение с одним неизвестным, найти число n.
Задача
№ 3.
Определить
формулу аминокислоты, если известно, что она содержит 15,73 % азота.
Дано:
Решение:
ω(N) = 15,73
% 1. Oбщая
формула аминокислот:
CnH2n(NH2)COOH
М.Ф. = ?
2. Выразим
через n
молекулярную массу:
Мr(CnH2n(NH2)COOH)
= 12n + 2n + 16 + 45 = 14n + 61.
3. Подставим
данные в формулу: 0,1573 = 14 ∙ 1 / 14n + 61.
2,2022n + 9,5953 =
14.
2,2022n = 4,4047
n = 2 Ответ: C2H4(NH2)COOH.
2. Вывод формул по
уравнениям реакций в общем виде, если известны данные для двух веществ.
Алгоритм решения:
1. Составить
уравнение реакции в общем виде.
2. Выразить
молярные массы неизвестных веществ через число n.
3. Найти
количества двух веществ по формулам:
n = m /M
n = V / Vm
4. Составить
уравнение, приравняв найденные количества веществ с учётом соотношения
числа моль этих веществ по уравнению (определяют по коэффициентам).
5. Решить
уравнение с одним неизвестным, найти число n и записать
формулу.
Задача № 4.
При взаимодействии предельного
одноатомного спирта массой 3 г с избытком натрия было получено 0,56
л водорода. Определить формулу спирта.
Дано:
m спирта = 3г Решение:
V(H2) =
0,56л 1. Напишем уравнение реакции в общем виде:
2CnH2n + 1 OH + 2Na ® H2 + 2CnH2nONa
М.Ф. = ? 2
моль 1 моль
2. Выразим
молярную массу спирта через число n:
M(CnH2n + 1OH) = 12n + 2n + 1 + 16
+ 1 = 14n +
18(г/моль).
3.
Найдём количества веществ:
n(СnH2n + 1OH) = m / M = 3г
/ 14n + 18г/моль
=
= 3 / 14n + 18 моль
n(Н2)
= V / Vm = 0,56л
/ 22,4г/моль = 0,025 моль.
4. Из
уравнения реакции видно, что
n(СnH2n + 1OH) = 2 ∙ n(H2)
5. Cоставим
уравнение: 3 / 14n + 18 = 2
∙ 0,025
n = 3
Ответ: С3Н7ОН.
3. Вывод
формул по уравнениям реакций в общем виде с применением закона сохранения массы
веществ.
Если
известны массы всех реагентов и продуктов реакции, кроме одного вещества, то
можно найти его массу на основании закона сохранения массы веществ.
Рассмотрим этот
случай на конкретном примере.
Задача № 5.
Некоторый
сложный эфир массой 7,4г подвергнут щелочному гидролизу. При этом получено 9,8г
калиевой соли предельной одноосновной кислоты и 3.2г спирта. Установите формулу
этого эфира.
Дано:
m(эфира) = 7,4г Решение:
m(соли) =
9,8г 1. Составим уравнение гидролиза эфира в общем виде:
m(спирта) = 3,2г R1COOR2
+ KOH ® R1COOK
+ R2OH
1
моль 1 моль 1 моль 1 моль
М.Ф.(эфира) = ?
2. По закону сохранения массы веществ:
m(R1COOR2)
+ m(KOH) = m(R1COOK) + m(R2OH)
Найдём
массу и количество гидроксида калия:
m(KOH)
= m(R1COOK) + m(R2OH) – m(R1COOR2)
=
=
9,8 + 3,2 – 7,4 = 5,6г
n(КОН) =
5,6г / 56г/моль = 0,1 моль
3. Найдём молярную массу соли и её формулу:
n(R1COOK) = n(KOH) = 0,1
моль
M = m / n = 9,8г
/ 0,1моль = 98 г/моль
M(R1) = 98 – M(COOK) = 98 –
83 =
= 15г/моль Þ СH3СOOK
4. Найдём молярную массу спирта и его формулу:
n(R2OH)
= n(KOH) = 0,1 моль
M(R2OH) = m / n = 3,2г /
0,1г/моль = 32 г/моль
M(R2) = 32 – M(OH) = 32 –
17 = 15г/моль Þ СH3OH
5. Следовательно,
формула эфира – СН3СООСН3.
Ответ: СН3СООСН3.
Фреоны
Задача. В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
Данная задача предназначена для десятиклассников, которые еще не освоили курс кислородсодержащих органических соединений, поэтому даны массовые доли.
1. Начнем с фреона № 1. При его сжигании образовалось 2,24 л углекислого газа. Найдем количество углекислого газа. Делим его объем на молярный объем и получаем 0,1 моль. Соответственно, атомов углерода тоже 0,1 моль, поскольку в каждой молекуле углекислого газа содержится один атом углерода.
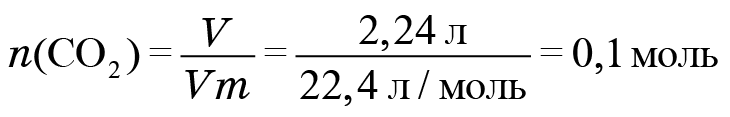
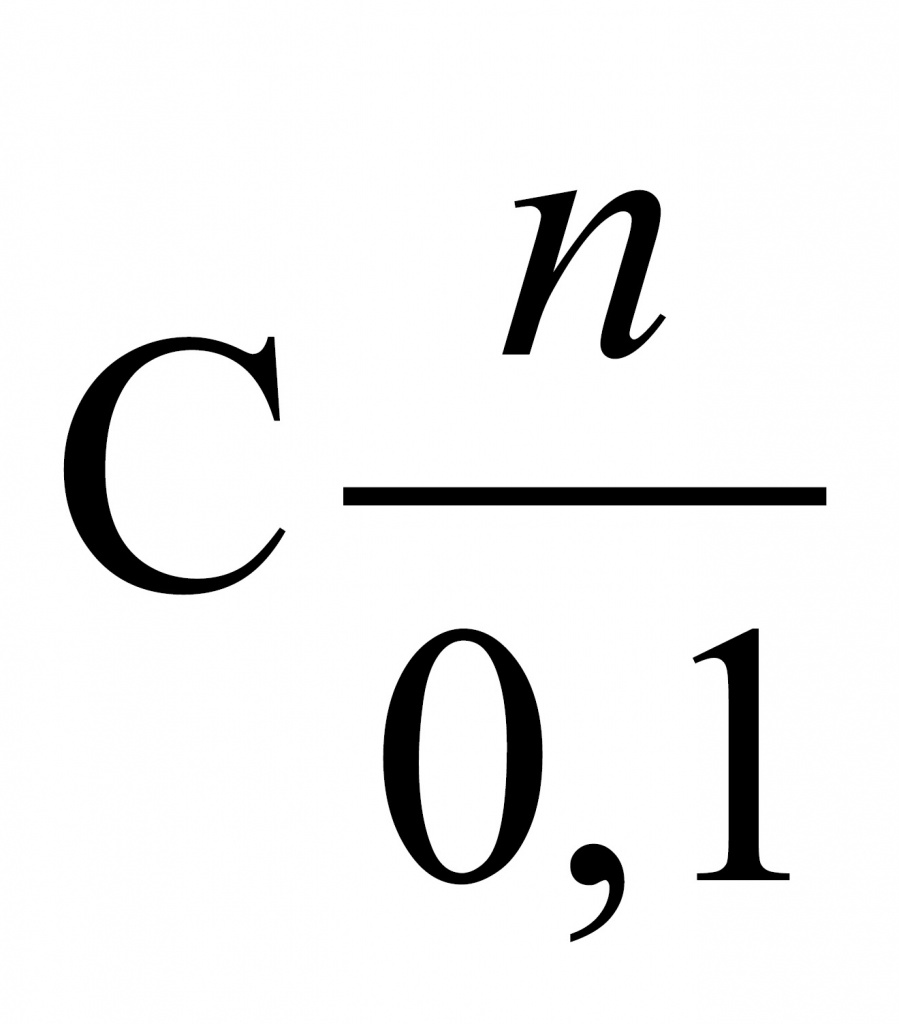
Информацию по водороду возьмем из фтороводорода. Найдем количество фтороводорода. Поскольку дана его масса, мы должны поделить массу (4 г) на молярную массу. Молекула фтороводорода состоит из атома фтора и атома водорода. Масса атома фтора 19, у водорода масса 1, значит, молярная масса 20. И мы получаем 0,2 моль.
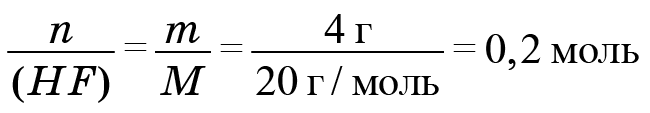
Следовательно, H = 0,2 и F = 0,2. Формула вещества, фреона № 1: CH2F2 (на один атом углерода приходится два атома водорода и два атома фтора).

2. Узнаем, что скрывается под фреоном № 2. Известно, что он не горит, и дана его плотность по водороду. Это относительная плотность, которая показывает, во сколько раз молярная масса вещества больше молярной массы (в данном случае) водорода. Молярная масса фреона № 2 равна 121 г/моль.
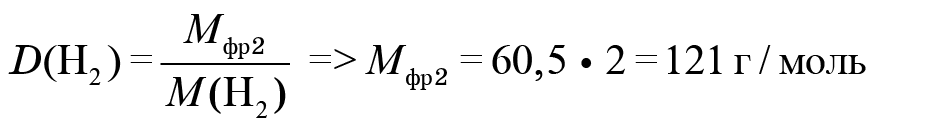
Сколько атомов углерода во фреоне № 2? Для подсчета используем массовую долю углерода. Масса углерода равна: молярную массу умножить на массовую долю. Получаем 12. Значит, в данной молекуле фреона № 2 содержится только один атом углерода.
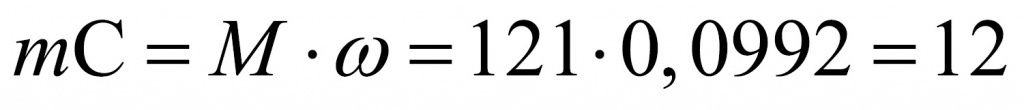
Нарисуем этот атом углерода. У него имеется четыре связи, поскольку в органической химии углерод четырехвалентный. Попробуем определить атомы, исходя из того, что в сумме один атом углерода и все остальные атомы должны равняться молярной массе (равной молекулярной) 121. Попробуем рассчитать. Если это четыре атома фтора, то получается мало. А если это четыре атома хлора, то много. Возьмем нечто среднее: половина — атомы фтора и половина — атомы хлора. Единица в показателе 121 говорит о том, что имеются нечетные значения. Молярная масса хлора 35,5. Для того чтобы получить целое численное значение, вероятно, нужны два атома хлора.
121 – 71 – 12 = 38 (ровно на два атома фтора)
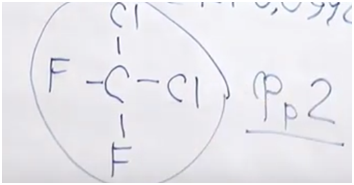
3. Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
100 – 39,58 – 10,42 = 50
Проверим вариант, что там только хлор и нет других атомов. Предположим, что там всего один атом углерода (его масса будет равна 12). Посчитаем, какая масса при этом будет приходиться, например, на атом фтора.
12 ∙ 39,58 : 50 = 9,5
Как указано в периодической системе Менделеева, атомная масса фтора — 19. Ровно половина одного атома фтора — 9,5, так что в составе этой молекулы не может быть один атом углерода, их должно быть как минимум два. Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
24 ∙ 10,42 : 50 = 5
Поскольку у нас один атом фтора, пять атомов водорода и два атома углерода, мы имеем дело с фторэтаном.

4. Что касается фреона № 4, то в реакции с натрием образовались этан и фторид натрия. Это реакция Вюрца — Фиттига. Мы имеем исходное вещество фторметан, которое реагирует с натрием, и образуются этан и фторид натрия.
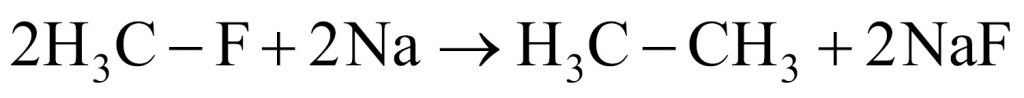
5. Переходим к фреону № 5. Формиат натрия образуется при гидролизе трифторметана. Получается формиат натрия, фторид натрия и две молекулы воды.
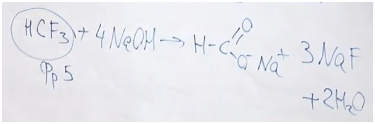
Посмотрев в справочную информацию, вы можете соотнести с кодами каждый из найденных фреонов.
Изучение фреонов очень интересно. Каждый тип холодильного оборудования требует особую марку фреона. Сегодня холодильное оборудование часто заполняют и углеводородами, поскольку, как известно, фреоны способствуют разрушению озонового слоя Земли. Но на сегодняшний день полного отказа от фреонов еще не произошло.

Химия. 10 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
Купить
Вильгельм Рудольф Фиттиг
Задача. Вещество, открытое в 1862 году немецким ученым Вильгельмом Рудольфом Фиттигом, представляет собой бесцветные кристаллы (tпл = +690С). Они широко применяются в качестве пищевой добавки для сохранения товарного вида фруктов (например, цитрусовых) путем нанесения на кожуру плода. Для установления состава вещество массой 15,4 г сожгли, образовалось 26,88 л (н.у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.
Похожую задачу часто можно встретить на ЕГЭ.
Начнем с определения молекулярной формулы вещества, то есть узнаем состав этой молекулы. Найдем количество углекислого газа, а оно равно количеству углерода. Разделим объем на молярный объем. Поскольку условия нормальные, молярный объем для газообразного вещества составляет около 22,4 л/моль.
26,88 л : 22,4 л/моль = 1,2 моль
Поскольку воды 9 г, а молярная масса воды 18 г, следовательно, воды 0,5 моль, а водорода 1 моль. Как такое может быть? В одной молекуле воды содержится целых два атома водорода. Но нам не сказано: соединение ли углеводородом? содержит ли кислород? Мы должны проверить наличие кислорода и найти массу углерода и водорода.
1,2 моль ∙ 12 = 14,4 г
Сумма углерода и водорода: 14,4 + 1 = 15,4. Следовательно, в составе неизвестного вещества нет кислорода.

Молярное соотношение показывает, что формула вещества С12H10. Почему не С6H5? Потому что в углеводородах никогда не бывает нечетного числа атомов водорода. Радикал С6H5 в химии называется фенилом. Иными словами, мы имеем соединение, которое называется в химии дифенил. На это также указывают химические свойства дифенила, и он является разрешенной пищевой добавкой. В магазинах можно встретить, например, апельсины, покрытые белым веществом — это и есть дифенил. Иногда его применяют в изрядном количестве, поэтому нужно тщательно мыть фрукты.
Составим уравнение реакции с избытком водорода. Очень просто посчитать, сколько атомов водорода потребуется на реакцию с дифенилом. Мы видим шесть двойных связей. Следовательно, на одну двойную связь нужна одна молекула водорода, а на шесть двойных связей — шесть молекул водорода при исчерпывающем гидрировании. Конечно, на platinum-катализаторе, потому что соединение ароматическое и требует преодоления достаточно высокого энергетического барьера. Мы получаем соединение, которое нельзя назвать никак иначе, кроме как дициклогексил.

Соединение дифенил и было открыто Рудольфом Фиттигом в 1862 году с температурой плавления 69°С.
Желеобразующая жидкость
Задача. Некоторая нерастворимая в воде жидкость при хранении на воздухе способна уплотняться, превращаясь в желе. Химик отобрал, отмерив, некоторый объем этой жидкости и установил, что при действии избытка раствора брома в четыреххлористом углероде образовалось 26,4 г дибромида. А при действии раствора хлора на такой же объем этой жидкости образовалось 17,5 г дихлорида. Определите структурную формулу этой жидкости, если известно, что в ее состав входят только атомы водорода и углерода. Составьте уравнение реакции полимеризации этой жидкости.
Обозначим неизвестную жидкость-углеводород через формулу CXHY. О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
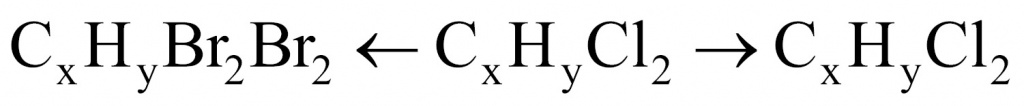
Для решения данной задачи нужно применить прием, известный в учебной химии как прием вычитания массы. Представим, что жидкости у нас ровно 1 моль. В этом случае разница между массой дибромида и дихлорида будет разницей между массой брома и хлора.
Молекула брома имеет массу 160, а молекула хлора — 71. Получаем 89. То есть если бы вещества у нас было 1 моль, то разница составила бы 89 г. Вычислим разницу массы дибромида и дихлорида:
26,4 – 17,5 = 8,9
Искомого вещества 0,1 моль.
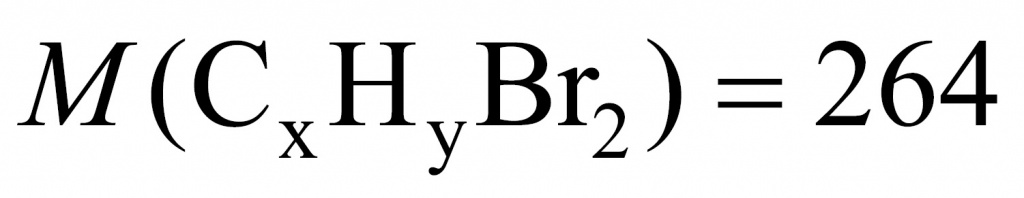
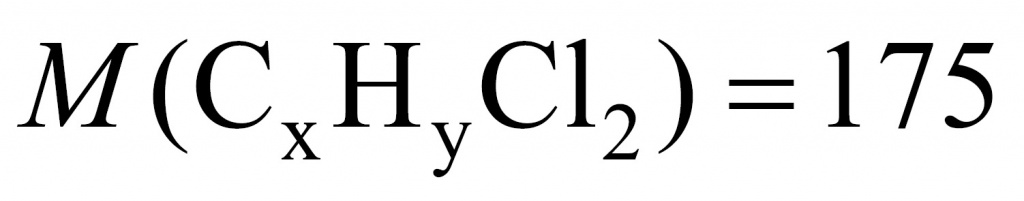
Теперь установим формулу. Обратимся к молекулярной записи. На углеводородную часть приходится 104. Сколько там может быть углеродов и водородов? Если углеродов 8 (что подходит), тогда на углероды приходится 96 и на водороды — 8.
Формула углеводорода C8H8.
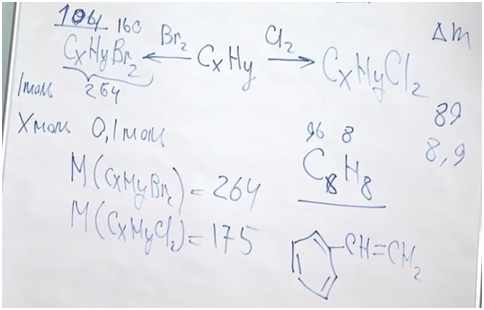
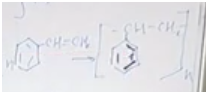
Разберемся, о каком углеводороде идет речь. Обратим внимание, что соединение непредельное, но оно способно присоединить только одну молекулу брома или одну молекулу хрома. Значит, исходя из малого числа атомов водорода по отношению к атомам углерода, скорее всего, это соединение есть не что иное, как производное бензола, то есть ароматическое соединение. В бензоле шесть атомов углерода и пять атомов водорода в остатке. У нас получается кетастирол.
Чтобы не было полимеризации, обычно в тот стирол, который можно купить в магазине, добавляют стабилизатор.
Уравнение полимеризации. Из n молекул стирола получается полимер, состоящий из n фрагментов.
Полистирол — это, например, одноразовая посуда. Она наносит существенный вред окружающей среде, и сейчас идет речь о том, чтобы ее запретить.
Отдушка для мыла
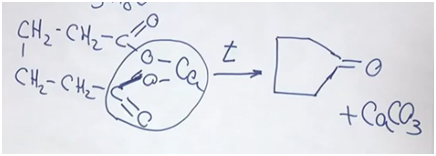
Задача. Некоторое легкоплавкое вещество, обладающее приятным запахом, используют в качестве ингибитора полимеризации, в качестве отдушки для мыла. При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.
По данным задачи, углекислый газ составляет 0,1 моль, соответственно, столько же и углерода. Поскольку воды 7,2 г, что в молях 0,4, то водорода 0,8. Проверим на наличие кислорода. Масса углерода 6, масса водорода – 0,8. Поскольку общая масса сожженного вещества составляет 8,4, то на кислород приходится масса 1,6 (в молях 0,1). Получается молекулярная формула C5H8O.

Перейдем к структурой формуле вещества. Вещество не реагирует с бромной водой — из этого можно делать вывод, что нет кратных соединений (то есть двойных, тройных углерод-углеродных связей). Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
Циклопентанон как раз используют в качестве отдушки для мыла.
Ошибка А. М. Бутлерова
Задача. Установите структурную формулу альдегида, в определении которой немного ошибся великий А. М. Бутлеров, если известно, что в результате взаимодействия 100 г 0,9%-го раствора этого вещества с избытком раствора перманганата калия образуется осадок массой 3,48 г. Составьте уравнение реакции этого альдегида с раствором перманганата калия.
Все великие химики ошибались, в том числе и А. М. Бутлеров.
Для начала вспомним, как альдегиды взаимодействуют с перманганатом калия. Мы не знаем, о каком альдегиде идет речь. Допустим, у него была одна альдегидная группа (хотя, если в соединении две альдегидные группы, он все равно будет альдегидом). Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
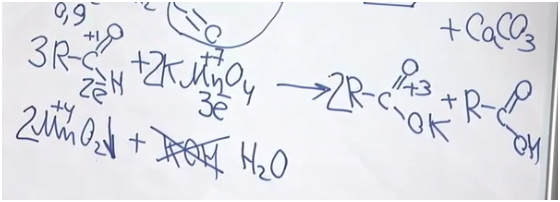
После составления уравнения найдем массу альдегида и массу осадка. Но осадок — это, разумеется, оксид марганца (IV).
Поскольку у нас 100 г 0,2%-го раствора и на 1% приходится 1 г, масса альдегида 0,9 г. Чтобы найти количество оксида марганца, 3,48 разделим на молярную масса оксида марганца — 87. Получаем 0,04 моль. В соответствии с этим уравнением альдегида у нас должно быть больше в полтора раза: 0,06 моль.
Найдем молярную массу альдегида.
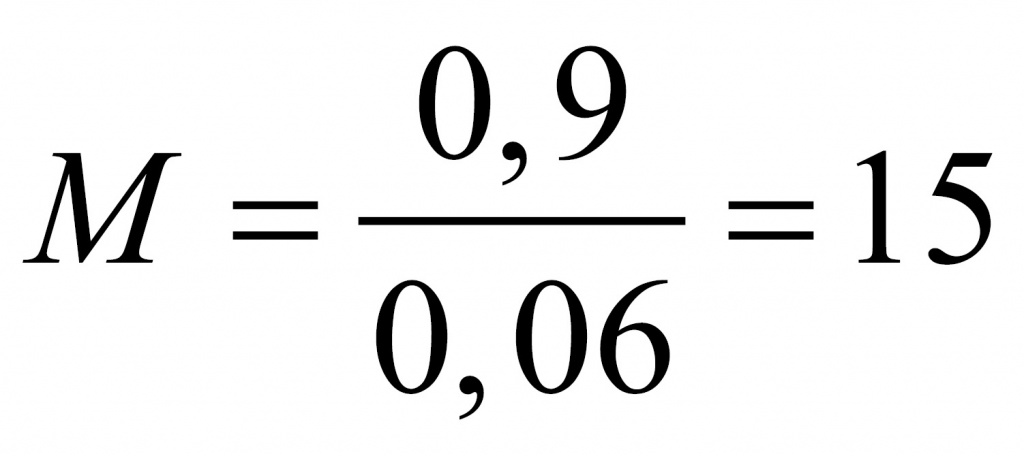
Где вы видели альдегид с молярной массой 15? Только на атом кислорода приходится 16. Значит, что либо альдегид содержал две альдегидные группы, либо это был формальдегид. Если бы он содержал две альдегидные группы, он бы отдал не два, а четыре электрона. Столько же отдал бы и формальдегид. Перманганат калия принимал бы три электрона. У оксида марганца (IV) было бы 4 моль. В этом случае оксида марганца 0,4 моль, а альдегида 0,3 моль.

Тогда
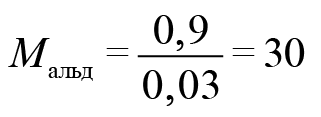
Следовательно, искомый альдегид — формальдегид. CH2O.
А. М. Бутлеров изначально определил формулу как C2H4O2.

Химия. 11 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии для старшей школы, изложенный в учебнике «Химия. Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
…ловая кислота
Задача. На полке в химической лаборатории стояла склянка с полустертой надписью. Единственное, что можно было разобрать: «…ловая кислота». Для установления состава кислоты провели ряд экспериментов. Для полной нейтрализации раствора, содержащего 0,36 г этой кислоты, понадобилось 50 мл 0,1-молярного раствора гидроксида натрия. Такая же навеска кислоты смогла обесцветить V = 80 мл (ω = 1%, ρ ≈ 1 г/мл) бромной воды. Восстановите надпись на склянке.
Обозначим формулу кислоты (будем считать, что она монокарбоновая). Если она одноосновная, то реакция идет один к одному. Найдем количество гидроксида натрия: 50 миллилитров 0,1-молярного раствора. У нас раствор, в одном литре которого содержится 0,1 моль вещества. Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
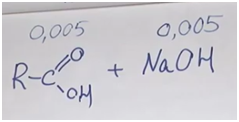
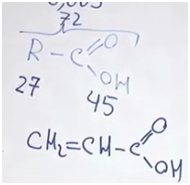
Отсюда легко находим молекулярную массу карбоновой кислоты.
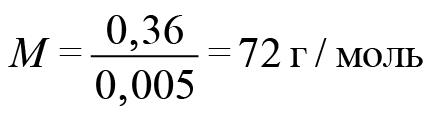
На карбоксильную группу приходится 45. Значит, на углеводородную часть приходится 27. В них поместятся два атома углерода и три атома водорода. Искомая кислота — акриловая.
Электроны
Задача. 0,800000 кг вещества содержит 0,2743 г электронов. Установите формулу вещества, если известно, что масса электрона равна 0,0005486 а.е.м.
Начнем с количества электронов. Масса электронов у нас известна и молярная масса тоже.
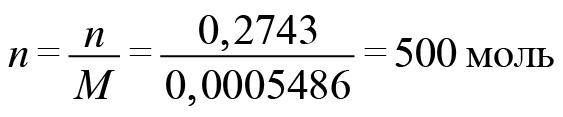
Число протонов равно количеству электронов:
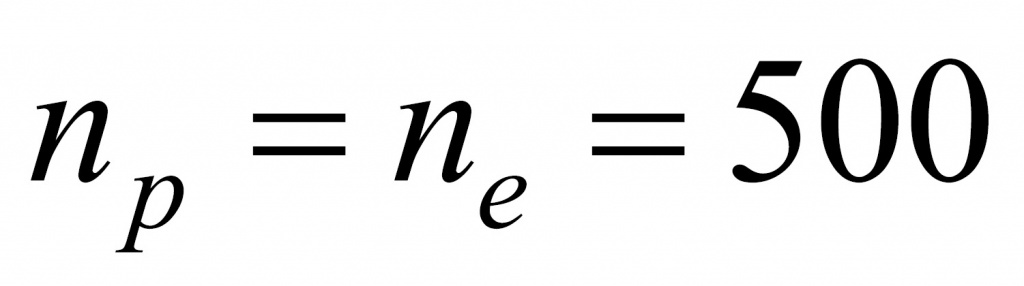
Отсюда находим массу, которая приходится на нейтроны (поскольку с точки зрения школьной химии любое число состоит из протонов, нейтронов и электронов). Обычно мы пренебрегаем массой электронов, но в данной задаче ей пренебрегать не нужно.
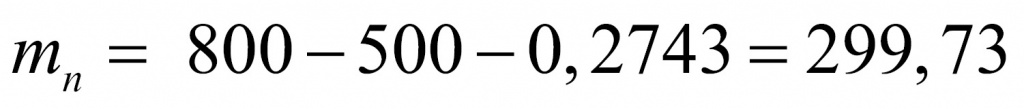
Получается интересное вещество. Обычно в атомах число нейтронов либо равно числу протонов, либо больше. В данном веществе протоны преобладают. Скорее всего, мы имеем дело с водородным соединением. Найдем соотношение между числом протонов и числом нейтронов.
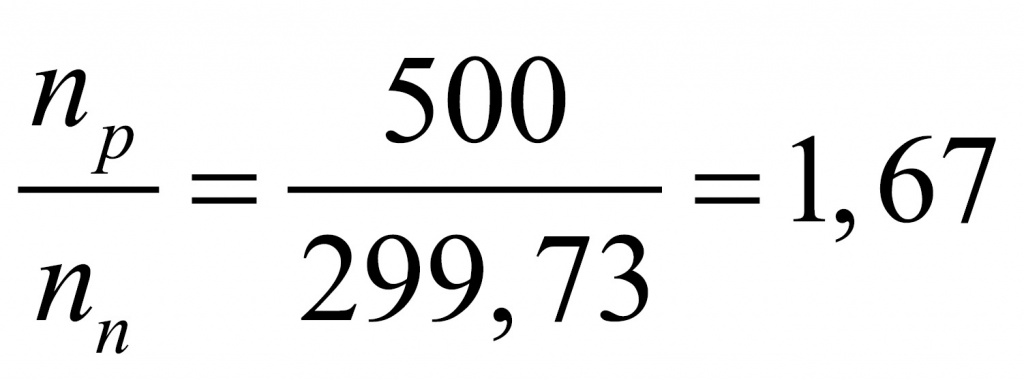
Если мы переберем водородные соединения элементов второго периода, то для метана получим, что в составе метана протонов буде 10, а нейтронов — 6.
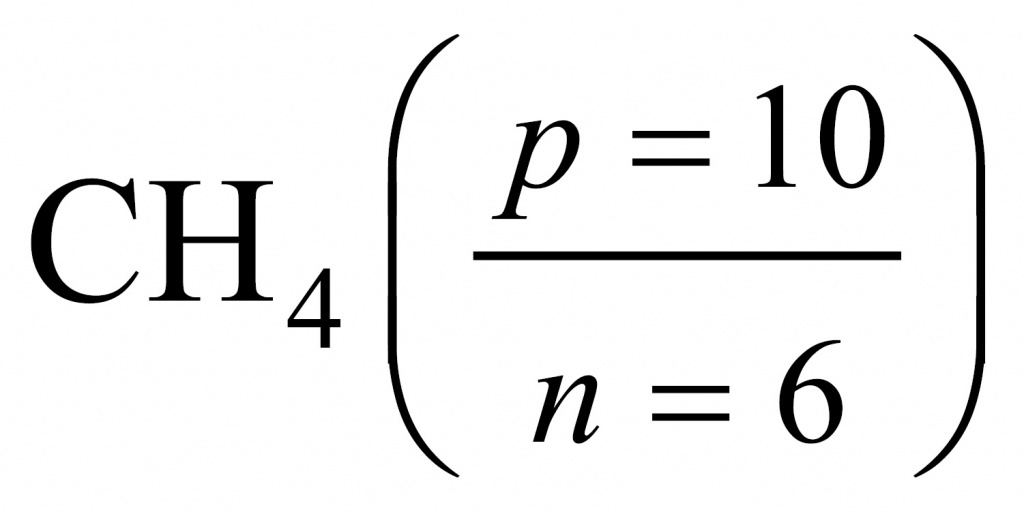
Поделив 10 на 6, получаем 1,67. Следовательно, искомым соединением был родоначальник предельных углеводородов, первый член гомологического ряда — метан.
#ADVERTISING_INSERT#
Населенный пункт: Самарская область. г.Кинель, п.г.т.Усть-Кинельский
1. При сгорании 9 г первичного амина выделилось 2,24 л азота. Определите молекулярную и структурную формулу амина, приведите его название.
Элементы ответа:
- Записана стехиометрическая схема реакции горения амина:
2RNH2 →N2
- Найдено количество вещества амина:
n(RNH2)=2n(N2)=2*2,24/22,4=0,2 моль
- Определена молярная масса амина:
M=m/n=9/0,2=45 г/моль
- Установлена молекулярная формула амина: на радикал R приходится
45-(14+2)=29. Таким радикалом может быть только этил C2H5
Молекулярная формула амина C2H5NH2
- Записана структурная формула амина и дано его название:
CH3-CH2-NH2 этиламин
2 Какую молекулярную формулу имеет одноатомный спирт, при взаимодействии 14,8г которого с металлическим натрием выделяется 2,24л водорода?
Элементы ответа:
1) Составлено уравнение реакции
2CnH2n+1ОН + 2Na → 2CnH2n+1ОNa + H2↑
Определены количества веществ спирта и водорода
n(H2) = 2,24л : 22,4л/моль = 0,1 моль
по уравнению реакции
n(CnH2n+1ОН ) : n(H2) = 2 : 1
следовательно, прореагировало 0,2 моль спирта
2) Определено число атомов углерода в радикале и установлена
формула спирта
14,8г : (14 n + 18) = 0,2
n = 4 С4Н9ОН бутанол
3. Массовая доля азота в одноосновной аминокислоте равна 15,73 %. Установите молекулярную формулу кислоты
Элементы ответа.
1) Записана общая формула аминокислоты и рассчитана её молярная масса:
Общая формула аминокислоты
CnH2n(NH2) COOH
ω(N) = 14/ М(кислоты)
М(кислоты) = 14/0,1573 = 89
2) найдено число атомов углерода в молекуле кислоты и установлена её формула:
Определяем число атомов углерода
М= 12n+2n+14+2+12+32+1 = 89
14n = 89 – 61
14n = 28
n = 2 Формула кислоты C2H4(NH2)COOH
4. В реакции «серебряного зеркала» 0,66г альдегида образует 3,24г осадка. Установите молекулярную формулу альдегида.
Элементы ответа:
- Составлено уравнение химической реакции и рассчитана
молекулярная масса альдегида:
0,66г 3,24г
СnH2n+1 – COH + Ag2O → 2 Ag + СnH2n+1 – C OOH
n = 1 моль n = 2 моль
m = M·n m = M·n
m = M m = 216г
0,66 3,24
М = 216
М = 44 г/моль, Мг = 44
- Найдено число атомов углерода и установлена молекулярная
формула альдегида.
12n + 2n +1 + 12 +16 + 1 = 44
14n + 30 = 44
14n = 14 CН3 – СOH
n = 1
5. При взаимодействии 0,672л алкена (н.у.) с хлором образуется 3,39 г его дихлорпроизводного. Определите молекулярную формулу алкена, запишите его структурную формулу и назовите
Элементы ответа:
1) Составлено уравнение хлорирования алкена:
СnH2n + Cl2 → СnH2nCl2
определено количество вещества алкена:
n(СnH2n) = 0,672 / 22,4 = 0,03 моль
2) Показано, что количество веществ алкена и дихлоралкана равны
n(СnH2nCl2) = n (СnH2n) = 0,03 моль
3) Рассчитана молярная масса алкена
М(СnH2nCl2) = m/n = 3,39/0,03 = 113 г/моль
4) Рассчитано число атомов углерода (n) в молекуле алкена
12n + 2n + 71 = 113
n = 3
Составлены молекулярная и структурная формулы алкена и дано его название:
С3Н6 , СН3 – СН = СН – СН3, пропен
6) При взаимодействии 11,6г предельного альдегида с избытком гидроксида меди(II) при нагревании образовался осадок массой 28,8г. Выведите молекулярную формулу альдегида
Элементы ответа:
1) Записано уравнение реакции в общем виде и найдено количество вещества альдегида:
CnH2n+1CHO + 2Cu(OH)2 → CnH2n+1CHO + Cu2O + 2H2O
n(CnH2n+1CHO) = n(Cu2O) = 28,8/144 = 0,2(моль).
Рассчитана молярная масса альдегида:
M(CnH2n+1CHO) = 11,6/0,2 = 58(г/моль).
2) Определено число атомов углерода в молекуле альдегида и установлена его формула:
M(C nH2n+1CHO) = 12n + 2n + 1 + 12 + 1 + 16 = 14n + 30;
14n + 30 = 58; n = 2; C2H5CHO
7. При термическом разложении вещества образовалось 16 г CuO, 18,4 г NO2 и 2,24 л кислорода (н.у.).
Определите формулу вещества, если его молярная масса равна 188 г/моль.
Элементы ответа:
- Рассчитаны количества веществ меди и кислорода в CuO, а также азота и кислорода в NO2:
n(Cu) = n(O) = n(CuO) = 16/80 = 0,2 моль
n(N) = 18,4/46 = 0,4 моль
n(O) = 2n(NO2) = 2 · 0,4 = 0,8 моль
- Рассчитано суммарное количество вещества кислорода:
n(O2) = 2,24/22,4 = 0,1 моль
n(O)общ. = 0,2 + 0,8 + 0,1 · 2 = 1,2 моль
- Определена формула: n(Cu) : n(N) : n(O) = 0,2 : 0,4 : 1,2 = 1 : 2 : 6
CuN2O6 или Cu(NO3)2; Mr(Cu(NO3)2) = 188

Элементы ответа:
1) Составлены уравнения реакций алкена с различными галогеноводородами:
CnH2n + HBr → CnH2n+1Br, CnH2n + HCI → CnH2n+1CI.
2) Показано, что в результате реакций образуется одинаковое число молей галогенопроизводных и рассчитано число атомов (n) в молекуле алкена:
n(CnH2n+1CI) = n(CnH2n+1Br),
7,85/(14 n +36,5) = 12,3/(14 n +81), n = 3
Определена молекулярная формула алкена: C3H6.
Решение задач на вывод химических формул
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
|
Вывод химической формулы вещества: |
Вычисление молярной массы вещества |
Задачи для самостоятельного решения |
|
— на основании массовых долей (%) атомов элементов |
M, где n — число атомов |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
|
— на основании массовых долей (%) атомов элементов и относительной плотности соединения |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
|
— по относительной плотности вещества и общей формуле класса |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
|
— на основании массовых долей (%) атомов элементов и плотности в газообразном состоянии |
М находится по М (в-ва)=Vm·ρ |
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. |
|
— по массе или объёму исходного вещества и продуктам горения |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
1)Определите молекулярную формулу предельного углеводорода, если
а) относительная плотность по водороду равна 43;
б) относительная плотность по кислороду равна 4,44
Дано: Решение:
D (CxHу) Н2 = 43 1.Найдём молекулярную массу
СnH2n+2 М CxHу = D(CxHу)Н2 Мr(Н2)
X -: У- ? (n)
2. Найдём количество атомов, составив уравнение
СnH2n+2 =86 (Вместо С и Н подставим числовые значения их относительных атомных масс и придём к математическому уравнению)
12n + 2n + 2 = 86; 14n = 86 – 2; 14n = 84; n = 6 => C6H14
2) Вывести химическую формулу алкена, если его плотность равна 3,125 г/л.
3) Вывести химическую формулу алкина, если 1 литр его весит 3,04г.
4) Вывести химическую формулу альдегида, если его относительная плотность по воздуху равна 2.
5) Вывести химическую формулу карбоновой одноосновной кислоты, если плотность паров равна 3,93 г/л.
6) Вывести химическую формулу однозамещённого хлорпроизводного предельного углеводорода, если его относительная плотность по воздуху равна 2,224.
8-7. Какой газообразный алкан имеет при нормальных условиях плотность 1,339 г/л?
8-8. Алкан имеет плотность паров по воздуху 4,414. Определить формулу алкана.
8-9. Молекула алкана содержит 26 электронов. Установите его формулу.
8-24. При бромировании углеводорода было получено бромпроизводное, имеющее относительную плотность по кислороду, равную 5,094. Определите возможное строение углеводорода, предложите способ его получения из неорганических реагентов.
8-26.Приведите структурные формулы циклоалканов, в молекулах которых находится по 40 электронов.
8-27. Алкен имеет молекулярную массу – 84. Определите его молекулярную формулу.
8-28. В молекуле циклоалкена число атомов углерода и водорода различается на 4. Приведите структурные формулы этого соединения и его изомера, не относящегося к циклическим углеводородам.
8-29. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название одного изомера исходного алкена.
15-43. Относительная плотность паров хлоралкана по алкену, из которого он получен, равна 1,87. Установите строение алкена
15-2.Молекулярная масса алкина – 96. Что это за алкин?
15-1. Определить формулу ароматического углеводорода с относительной молекулярной массой 92.
15-7. Приведите структурную формулу ароматического углеводорода, имеющего в молекуле 50 электронов
1.18 (3) Относительная плотность паров алкана по водороду равна 57. Выведите молекулярную формулу алкана.
1.19 (3) Относительная плотность паров алкана по азоту равна 5,07. Выведите молекулярную формулу алкана.
2.7 (3) Относительная плотность паров циклоалкана по кислороду равна 3,5. Выведите молекулярную формулу циклоалкана.
2.8 (3) Плотность циклоалкана при нормальных условиях равна 1,875 г/л. Выведите молекулярную формулу циклоалкана.
2.13 (3) Углеводород имеет относительную плотность по азоту 2,5. Он не обесцвечивает бромную воду. Предположите возможную структуру углеводорода. Дайте название.
2.14 (3) Углеводород имеет относительную плотность по углекислому газу 1,9. Он не обесцвечивает холодный раствор перманганата калия. Предположите возможную структуру углеводорода. Дайте название.
3.12 (3) Относительная плотность паров алкена по водороду равна 42. Выведите молекулярную формулу алкена.
3.13 (3) Плотность алкена при н. у. равна 2,5 г/л. Выведите молекулярную формулу алкена.
4.11 (3) 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
4.12 (3) Относительная плотность паров алкадиена по кислороду равна 3. Выведите молекулярную формулу алкадиена.
4.13 (3) Относительная плотность углеводорода по воздуху равна 2,345. Массовая доля углерода в нем равна 88,24%. Выведите молекулярную формулу углеводорода.
5.13 (3) 1 г алкина при н. у. занимает объем 0,86 л. Выведите молекулярную формулу алкина.
5.14 (3) Относительная плотность паров алкина по воздуху равна 2,83. Выведите молекулярную формулу алкина.
.
6.15 (3) Относительная плотность по гелию паров углеводорода ряда бензола равна 23. Выведите его молекулярную формулу.
6.16 (3) Пары арена имеют относительную плотность по воздуху 4,14. Выведите его молекулярную формулу.
7.17 (3) Относительная плотность паров предельного одноатомного спирта по водороду равна 37. Выведите молекулярную формулу спирта.
7.18 (3) Относительная плотность паров предельного простого эфира по гелию равна 15. Выведите молекулярную формулу эфира.
8.8 (3) Относительная плотность паров предельного двухатомного спирта по кислороду равна 3,25. Выведите молекулярную формулу спирта.
8.9 (3) Относительная плотность паров предельного трехатомного спирта по метану равна 5,75. Выведите молекулярную формулу спирта.
10.13 (3) Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида.
10.14 (3) Относительная плотность паров предельного альдегида по неону равна 5. Выведите молекулярную формулу альдегида.
10.15 (3) Относительная плотность паров органического соединения по водороду равна 36. Массовая доля углерода в этом веществе равна 66,67%, массовая доля водорода равна 11,11%, а остальное приходится на кислород. Выведите молекулярную формулу органического соединения и предложите структуру, если известно, что это вещество: а) не дает реакции «серебряного зеркала»; б) дает реакцию «серебряного зеркала».
11.15 (3) Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
13.12 (3) Относительная плотность паров предельного амина по кислороду равна 1,844. Выведите молекулярную формулу амина.
13.13 (3) Относительная плотность паров ароматического амина по метану равна 6,75. Выведите его молекулярную формулу.
7) Углеводород (относительная плотность по водороду равна 39) содержит 92,31 % углерода и 7,69% водорода. Найдите его молекулярную формулу.
Дано: Решение:
W% (С) = 92, 31 1.Найдём молекулярную массу
W% (Н) = 7, 69 Мr (CxHу) = 39 2 = 78
D (CxHу)Н2 = 39 2. Найдём количество атомов, т.е. отношение
х : у = ? γ = т/Аr; х : у = ; => СН
3. Убедимся, истинная это формула или простейшая. Для этого найдём молекулярную массу (СН); Мr(СН) = 12 + 1 = 13, а у нас 78 => нашли простейшую формулу. Чтобы вывести истинную формулу вещества нужно
узнать сколько раз 13 уложится в 78,. именно на столько нужно будет увеличить количество атомов в простейшей формуле.
78: 13 = 6 => С6Н6
Mr (С6Н6) = 12 6 + 6 = 78
Или: m(С)=; m(Н)=78-72=6; х:у==6:6=>С6Н6

|
Дано: Вывести формулу соединения |
Решение: Рассчитать молярную массу кислоты CnН2n (N Н2) CОOH M кислоты = 75 (г/моль) |
Задача № 9. Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
|
Дано: |
Решение:
М (CхНу)= 21 · 2 = 42
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
|
Вывести формулу соединения |
Задача № 10 Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
|
Дано: |
Решение: |
|
Вывести формулу алкана |
Задача № 11
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
|
Дано: |
Решение: |
|
Вывести формулу соединения |
12. Определите формулу углеводорода, массовая доля углерода в котором
82,2 %, а плотность этого вещества составляет 2,59 г/л.
13. Определите формулу красителя-анилина. По данным анилина массовая доля углерода в нем 77,4%, водорода — 7,5 %, азота — 15,1 %. Относительная плотность паров этого вещества по воздуху равна 3,21.
14. Относительная молекулярная масса исследуемого вещества равна
237, массовая доля углерода в нем составляет 10,1 %, а хлора — 89,9. Установите формулу этого хлорзамещенного углеводорода.
15. Определите молекулярную формулу предельного углеводорода, плотность которого равна 1,97 г/л, а массовая доля углерода составляет — 0,82.
16. Какова формула вещества, при анализе состава которого
установлено: массовая доля углерода в нем равна 0,52; кислорода — 0,35, а
водорода — 0,13? Относительная плотность вещества по водороду составляет
23.
17. Определите молекулярную формулу кислородсодержащего органического вещества по данным анализа: массовая доля углерода — 54,55 %; массовая доля водорода — 9,09 %.
18. Углеводород содержит в массовых долях 0,8889 или 88,89 % углерод. Его плотность по воздуху равна 1,852. Найдите молекулярную формулу этого углеводорода.
19. Определите формулу вещества, если массовая доля азота в нем 30,43%, а кислорода — 69,57 %.
20. Химический анализ показал, что в 17 г соединения алюминия с кислородом содержится 9 г алюминия. Найдите простейшую формулу этого соединения.
21. Найдите простейшую формулу оксида хрома, содержащего 68,4 % хрома.
22. Найдите простейшую формулу вещества, содержащего 43,6 % натрия, 11,3 % углерода и 45,3 % кислорода.
23. При анализе навески 3,16 мт органического вещества обнаружено, что в его составе 0,96 мт углерода, 0,12 мг водорода и 0,8 мт кальция, а остальное приходится на кислород. Найдите простейшую формулу этого соединения.
24. Известно, что оксид некоторого металла содержит 11,11 % кислорода и в его молекуле на один атом кислорода приходится два атом, а металла. Определите, что это за металл, и о каком соединении идет речь.
25. Найдите формулу соединения, если известно, что в его состав входи-
1,59 % водорода, 22,22 % азота, 76,19 % кислорода.
26. Дано: углерода —92,3 %, водорода — 7,7 %, масса 1 л газа при н.у. 1,16 г. Определить молекулярную формулу.
27. Хлорпроизводное предельного углеводорода имеет молекулярную массу 237. Процентный состав этого соединения следующий: хлора — 89,9 %, углерода — 10,1 %. Найдите его молекулярную формулу.
1. Найдем массу хлора
237 0,899 = 213
237—213 = 24
х : .у=24/12 : 213/35,5=2 : 6=>С2С16.
28. Определите формулы двух оксидов одного и того же элемента, если его массовая доля в этих оксидах равна 88,11 и 84,75%. Этот элемент образует также фторид, содержащий 32,47 % фтора по массе.
29. Элемент ниобий образует более двадцати галогенводородов. Установите две формулы соединений ниобия с одним из галогенов, если содержание металла в них составляет 15,47 и 21,54 % по массе.
30. Относительная плотность по водороду неизвестного газообразного вещества равна 22. Найдите молекулярную формулу этого вещества, если массовая доля (С) в нем 54,55 %, (Н) — 9,09 %, (О) — 36,36 %.31. Найдите простейшую формулу соединения, имеющего следующий состав: Nа —42,1 %, Р — 18,9 %, О — 39,0 %.
8-1. Определите молекулярную формулу органического соединения с составом 80% углерода и 20% водорода, если плотность его по воздуху равна 1,034.
8-2. Определите молекулярную формулу углеводорода, который содержит 85,7% углерода и имеет плотность по водороду 21.
8-3. Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность паров вещества по воздуху 3,93. Определить формулу вещества.
8-4. Углеводород содержит 82,76% углерода и 17,24% водорода (по массе). При монохлорировании этот углеводород образует два изомерных алкилхлорида – первичный и третичный. Определить строение исходного углеводорода.
8-5. Органическое вещество содержит 91, 3% углерода и 8,7% водорода. Относительная плотность паров по кислороду равна 2,875. Вывести молекулярную формулу вещества.
8-6. Установите молекулярную формулу углеводорода, молекула которого содержит 40 электронов, а молекулярная масса которого 70.
8-10. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
8-11. Установите молекулярную формулу дибромалкана, содержащего 85,11% брома.
8-12. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
8-13. Монохлорпроизводное предельного углеводорода содержит 38.4% хлора. Определить формулу углеводорода.
8-14. Монохлорпроизводное предельного углеводорода содержит 38,4% хлора по массе. Определите, сколько атомов углерода содержится в молекуле этого вещества.
8-15. В монохлоралкане массовая доля хлора равна 55,04%. Определите формулу монохлоралкана.
8-16. Определите молекулярную формулу фторпроизводного алкана, в 34,27 г которого содержится 17,44 г фтора.
8-17. Определите молекулярную формулу хлорпроизводного алкана, в 35,24 г которого содержится 23,83 г хлора.
8-18. Дихлорпроизводное алкана содержит 5,31% водорода по массе. Определите молекулярную формулу дихлоралкана. Приведите структурную формулу одного из возможных изомеров и назовите его.
8-19. Вещество содержит 36.4% С, 6.1% Н и фтор. Молекулярная масса этого вещества меньше 110. Сколько всего атомов в этой молекуле?
8-20. Органическое вещество содержит 0,2424 доли углерода, 0,0404 доли водорода, 0,7172 хлора. Плотность паров по азоту составляет 3,5357. Определите химическую формулу этого вещества.
8-21. Органическое вещество содержит 0,2975 углерода, 0,0413 водорода, 0,6612 брома. Относительная плотность паров по воздуху равна 4,1724. Вывести молекулярную формулу вещества.
8-22. Хлорпроизводное предельного углеводорода имеет молекулярную массу 257. Процентный состав этого соединения следующий: хлор-89,9%, углерод-10,1%. Определите его молекулярную формулу.
8-23. При монохлорировании углеводорода, содержащего 83,72% С и 16,28% Н, образовалось 2 изомерных хлорпроизводных – первичное и третичное. Установите строение углеводорода, составьте формулы продуктов хлорирования
8-25. Содержание брома в соединении, полученном при взаимодействии алкена с бромом, составляет 69,56 мас.%. Определите структурную формулу алкена, если известно, что он может существовать в виде цис- и транс- изомеров.
.
15-10. Ароматическое соединение ряда бензола содержит 90.0% углерода. Нарисовать ео возможные изомеры.
15-48. Плотность по водороду вещества равна 22. Вещество имеет следующий состав: углерод — 54,55%, водород — 9,09%, кислород – 36,36% Вещество легко восстанавливает оксид серебра. Определить это вещество.
15-50. Органическое вещество природного происхождения содержит 40 мас.% углерода, 6,67 мас.% водорода и кислород. Сколько всего атомов содержит молекула этого соединения, если известно, что его молярная масса равна 180 г/моль?
15-26. В предельной одноосновной карбоновой кислоте массовая доля кислорода равна 43,24%. Определите формулу кислоты.
15-28. Предельная одноосновная карбоновая кислота содержит 48.6%С. Какая это кислота?
15-30. Установите молекулярную формулу предельной карбоновой кислоты, метиловый эфир которой содержит 9,09% водорода.
15-40. При взаимодействии первичного одноатомного спирта, содержащего 60% углерода и 13,3% водорода, с органической кислотой образовалось вещество, плотность паров которого по водороду равна
Определите молекулярную формулу каждого из веществ.
15-41. При взаимодействии одноатомного спирта, содержащего 52,17% углерода и 13,04% водорода, с органической кислотой, образуется вещество, плотность паров которого по водороду равна 51. Определите молекулярную формулу каждого вещества, участвующего в реакции, и дайте им название.
15-42. При взаимодействии одноатомного спирта, содержащего 37,5% углерода, 12,5% водорода, с органической кислотой образуется вещество, плотность паров которого по водороду равна 37. Определите молекулярную формулу каждого вещества, участвующего в реакции, и дайте им название.
15-49. Эфир с молярной массой 130 г/моль при гидролизе образует кислоту, в серебряной соли которой массовая доля серебра составляет 59,66%. Определите число атомов углерода в молекуле спирта, образовавшего эфир.
15-37. Определите молекулярную формулу предельного многоатомного спирта, в 31,25 г которого содержится 14,15 г кислорода.
15-39. Определите молекулярную формулу предельного многоатомного спирта, в 37,67 г которого содержится 16,62 г углерода.
15-14. Путресцин содержит 54,5% (С), 13,6% (Н), остальное приходится на азот. Плотность его паров по водороду равна 44. Установите молекулярную формулу путресцина.
15-15. Одно из важнейших химических соединений реагентов, относящихся к классу диаминов, содержит 40% (С) , 46,7% (N), остальное – водород. Установите молекулярную формулу этого органического соединения.
15-17. Вещество содержит 69,2 % С, 3,85 % Н и азот. Молекулярная масса этого вещества меньше 150. Сколько всего атомов в этой молекуле?
15-20. Предельный амин содержит 31.1% азота. Определите возможное строение этого амина.
15-21. Установите молекулярную формулу предельного третичного амина, содержащего 23,73% азота по массе.
15-29. Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу аминокислоты.
1.20 (3) Газообразный углеводород имеет относительную плотность по кислороду 1,375, а массовые доли углерода и водорода в нем составляют соответственно 81,8% и 18,2%. Какое это соединение?
1.21 (3) Относительная плотность паров углеводорода по кислороду равна 2,25. Массовая доля углерода в нем равна 83,33%. Выведите молекулярную формулу этого углеводорода.
1.22 (3) Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
2.9 (3) Относительная плотность паров углеводорода по азоту равна 3. Массовая доля углерода в нем равна 85,71%. Выведите его молекулярную формулу.
2.10 (3) Относительная плотность паров углеводорода по водороду равна 35. Массовая доля водорода в нем равна 14,285%. Выведите молекулярную формулу углеводорода.
3.14 (3) Относительная плотность паров углеводорода по азоту равна 3,5. Массовая доля углерода в нем равна 85,71%. Выведите молекулярную формулу углеводорода.
3.15 Углеводород массой 12,5 г при н. у. занимает объем 5 л. Массовая доля водорода в нем равна 14,29%. Выведите молекулярную формулу углеводорода.
5.15 Относительная плотность паров углеводорода по водороду равна 41. Массовая доля водорода в нем равна 12,2%. Выведите молекулярную формулу углеводорода
5.16 (3) Относительная плотность паров углеводорода по кислороду равна 2,125. Массовая доля углерода в нем равна 88,24%. Выведите молекулярную формулу углеводорода
6.17 (3) Относительная плотность паров углеводорода по углекислому газу равна 2,41. Массовая доля углерода равна 90,6%. Выведите молекулярную формулу углеводорода.
6.21 (1,3) При хлорировании на свету некоторого углеводорода получается единственное монохлорпроизводное, массовая доля хлора в котором равна 22,98%. Назовите исходный углеводород.
6.22 (1,3) При хлорировании на свету некоторого углеводорода получается единственное монохлорпроизводное, массовая доля хлора в котором равна 21,07%. Назовите исходный углеводород.
7.19 (3) Относительная плотность паров органического соединения по кислороду равна 2,75. Массовая доля углерода в этом веществе равна 68,18%, массовая доля водорода равна 13,64%, остальное — кислород. Выведите молекулярную формулу этого вещества.
7.20 (3) Относительная плотность паров органического соединения по воздуху равна 4. Массовая доля углерода в этом веществе равна 72,41%, массовая доля водорода равна 13,79%, массовая доля кислорода равна 13,79%. Выведите молекулярную формулу этого вещества.
8.7 (3) Относительная плотность паров органического вещества по углекислому газу равна 2,41. Массовая доля углерода в этом веществе равна 45,28%, массовая доля водорода равна 9,44%, а остальное приходится на кислород. Выведите молекулярную формулу этого вещества.
8.10 (3) Относительная плотность паров органического вещества по водороду равна 60. Массовая доля углерода в этом веществе равна 50%, массовая доля водорода равна 10%, массовая доля кислорода равна 40%. Выведите молекулярную формулу органического вещества.
9.5 (3) Относительная плотность паров органического соединения по метану равна 7,75. Массовая доля углерода в этом веществе равна 67,74%, массовая доля водорода равна 6,45%, а остальное приходится на кислород. Выведите молекулярную формулу этого соединения.
9.6 (3) Относительная плотность паров органического соединения по азоту равна 4,5. Массовая доля углерода в этом веществе равна 57,14%, массовая доля водорода равна 4,76%, массовая доля кислорода равна 38,10%. Выведите молекулярную формулу этого соединения.
10.16 (3) 10 л газообразного соединения при н. у. имеют массу 13,4 г. Массовые доли углерода и водорода в нем составляют соответственно 40% и 6,7%, остальное — кислород. Установите молекулярную формулу соединения.
10.17 (3) Относительная плотность паров органического соединения по кислороду равна 3,125. Массовая доля углерода в этом веществе равна 72%, массовая доля водорода равна 12%, остальное — кислород. Выведите молекулярную формулу этого соединения.
11.14 (3) Массовая доля углерода в предельной одноосновной карбоновой кислоте составляет 54,5%. Какая это кислота? Какие эфиры будут ее изомерами?
11.16 (3) Относительная плотность паров органического соединения по неону равна 5,4. Массовая доля углерода в этом веществе равна 58,82%, массовая доля водорода равна 9,8%, а остальное — кислород. Выведите молекулярную формулу органического соединения. Предложите возможные структуры.
11.17 (3) Относительная плотность паров органического соединения по кислороду равна 4,5. Массовая доля углерода в этом веществе равна 66,67%, массовая доля водорода равна 11,11%, массовая доля кислорода равна 22,22%. Выведите молекулярную формулу органического соединения.
13.14 (3) Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
13.15 (3) Массовая доля углерода в моноамине равна 63,16%, массовая доля азота равна 24,56%. Выведите молекулярную формулу амина.
14.10 (2) Выведите молекулярную формулу моноаминокарбоновой кислоты, массовая доля азота в которой составляет 11,97%.
14.11 (3) Массовая доля кислорода в предельном эфире аминоуксусной кислоты составляет 27,35%. Напишите возможные структурные формулы этого эфира.
Вывод формул по продуктам сгорания
Задача
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
|
Дано: |
Решение: Составляем пропорции: |
|
Вывести формулу |
1) При сгорании 3г. углеводорода было получено 8,8 г.углекислого газа,5,4 г. воды. Относительная плотность углеводорода по воздуху равна 1,03. Определите молекулярную формулу углеводорода.
3г. 8,8г. 5,4г.
CxHу + О2 = СО2 + Н2О
44г 18г
Т.к. -.это углеводород => кроме углерода и водорода в нём больше ничего не содержится. Весь углерод из углеводорода перешёл в 8,8г СО2, а водород в 5,4г Н2О.
1. Рассчитаем Мr (CxHу)
Мr (CxHу) = 1,03 29 = 30
2.Рассчитаем массу углерода в 8,8г СО2
Х = 2,4г
3. Рассчитаем массу водорода в 5,4г Н2О.
Х = 0,6
4. Рассчитаем количество атомов углерода и водорода
γ = т/Аr; х : у = ;=> С2Н6
5. Устанавливаем простейшая формула или истинная
Мr (С2Н6) = 12 2 + 6 = 30; Это истинная формула
2. При сгорании 1,84г органического вещества образовалось 2,64г углекислого газа и 1,44 г воды. Плотность горючего газа по кислороду равна 2,875. Определите молекулярную формулу вещества.
3. При сгорании 6,8 г газообразного неорганического вещества было получено 3,6 г воды и 12,8 г сернистого газа. Плотность горючего газа по кислороду равна 1,06. Определите молекулярную формулу вещества.
4. При сжигании 5,4 г паров неорганического вещества было получено
2,8 г. азота, 8,8 г углекислого газа и 1,8 г воды. Один литр паров этого вещества весит 1,205 г. Определите молекулярную формулу.
5. При сжигании 5,2 г вещества выделилось 8,96 л углекислого газа и 3,6 г воды. Определите молекулярную формулу вещества.
6. При сжигании 2,5 г вещества образовалось 3,42 г Н20 и 5,57 СО2. В состав вещества, кроме водорода и углерода, входит азот (23 %). Какова молекулярная формула.
7. При сжигании 3,1 г вещества (плотность по водороду 15,5), в котором обнаружены азот, водород и углерод, образуются 4,5 г воды; 4,4 г углекислого газа и 1,4 г азота. Определите молекулярную формулу вещества и процентный состав химических элементов.
8. При сжигании без остатка 4,3 г углеводорода получили 13,2 г оксида углерода (IV). Относительная плотность углеводорода по водороду равна 43. Определите молекулярную формулу вещества.
9. При сжигании 2,15 г органического вещества получено 6,6 г углекислого газа и 3,15 г воды. Относительная молекулярная масса этого вещества. равна 86. Установите формулу вещества.
10. Определите молекулярную формулу вещества, при сжигании 3,75 г которого получили 2,25 г водяного пара и 5,5 г оксида углерода (IV). Относительная плотность вещества по водороду равна 15.
11. При сжигании 2,8 л газа получили 8,4 л оксида углерода (IV) (н.у.) и
6,75 г паров воды. Плотность газа 1,875 г/л. Вычислите молекулярную
формулу вещества.
12. При сгорании 2,1 л органического вещества получили 6,6 г оксида углерода (IV), и 2,7 паров воды. Плотность паров исходного вещества по воздуху равна 2,9. Определите состав молекулы углеводорода.
13. При сжигании 2,6 г углеводорода получили 8,8 г оксида углерода (IV). Относительная плотность углеводорода по водороду равна 13. Определите формулу вещества.
14. При сжигании 4,5 г органического вещества получили 13,2 г оксида углерода (IV) и 8,1 г воды. Один литр исходного вещества имеет массу 1,35 г. Напишите его формулу.
15. В струе кислорода сожгли два образца вещества. При сгорании 0,9 г
вещества (А) образовалось 1,32 г углекислого газа и 0,54 г воды. При сгорании 1,71 г вещества (Б) выделилось 2,64 г углекислого газа и 0,99 г воды. Известно, что молярная масса вещества (А) 180 г/моль, а вещества (Б) 342 г/моль. Найдите молекулярные формулы этих веществ.
16. При сжигании углеводорода массой 8,8 г образовалось 26,4 г оксида углерода (IV). Плотность вещества (н.у.) равна 1,96 г/л. Найдите молекулярную формулу.
17. Найдите молекулярную формулу газообразного углеводорода, если при сжигании 5,6 л его (н.у.) было получено 16,8 л оксида углерода (IV) и 13,5 г воды.
18. Определите молекулярную формулу гомолога этилена, если известно, что
0,56 г могут присоединить 1,6 г брома.
19. При сжигании 0,72г летучей жидкости было получено 0,05 моль углекислого газа и 1,08 г воды. Плотность паров его по воздуху равна 2,5. Выведите формулу данного вещества.
20. Химическое соединение — газ, содержащий углерода 85,7% и водорода
14,3%. Образец этого соединения массой 5,25 г занимает при (н.у.) объем 2,8 л. Определите формулу соединения.
21. При сгорании вещества массой 4,25 г образовались углекислый газ массой 13,2 г и воды массой 5,85 г. Плотность паров вещества по воздуху равна 5,862. Определите формулу вещества.
9-1. При полном сгорании органического вещества массой 13,8г получен оксид углерода (IV) , массой 26,4г и вода, массой 16,2 г. Найдите формулу вещества, если для него плотность по водороду равна 23.
9-2. При сжигании газообразного углеводорода с плотностью по водороду 21 получено 8,4л оксида углерода(IV) (н.у.) и 6,75 г воды. Определите формулу углеводорода.
9-3. При сжигании 3,9 г органического вещества, плотность паров которого по водороду 39, образовалось 13,2 г оксида углерода(IV) и 2,7 г воды. Какова структурная формула исходного соединения?
9-4.При сжигании 29 г вещества образовалось 44,8 л СО2 (н.у.) и 45 г воды. Относительная плотность вещества по воздуху равна 2. Определить молекулярную формулу вещества.
9-5. При сжигании 8,4 г органического вещества получено 26,4г углекислого газа и 10,8 г воды. Плотность паров этого вещества по воздуху равна 2,9. Определите молекулярную формулу вещества. К какому гомологическому ряду оно относится?
9-6. При сжигании 28 мл газа получено 84 мл оксида углерода(IV) и 67,5 мг воды (н.у.). Плотность газа по водороду равна 21. Определите молекулярную формулу газа.
9-7. К какому классу органических соединений должно относиться вещество, при сжигании 11 г которого образуется 11,2 л (н.у.) оксида углерода(IV) и 9 г воды, если молярная масса этого вещества равно молярной массе углекислого газа?
9-8. При сгорании 1,86 г органического вещества образовалось 3,96 г углекислого газа и 0,54 г воды. Сколько всего атомов содержит молекула этого соединения, если известно, что его молярная масса меньше 200 г/моль?
9-9. Определите молекулярную формулу газа, если известно, что при сжигании 2,24 л его образовалось 4,48 л углекислого газа (н.у.) и 1,8 г воды. Плотность газа по воздуху равна 0,8966.
9-10. Определите молекулярную формулу углеводорода, если известно, что при сгорании его объемом 0,0112 м3 (н.у.) образуется углекислый газ объемом 0,0336 м3 и пары воды массой 0,036кг.
9-11. При сжигании углеводорода массой 8,4 г образовалось 26,4 г углекислого газа. Плотность вещества при н.у. равна 1,875 г/л. Найдите его молекулярную формулу.
9-12.При сгорании 11,2 л газа получилось 33,6 л СО2 и 27 г воды. 1 л газа при н.у. весит 1,875 г. Определить молекулярную формулу газа.
9-13. Определите молекулярную формулу углеводорода, если известно, что 1,3 г его при сжигании образуют 2,24 л оксида углерода (IV) и 0,9 г паров воды. Масса 1 мл этого углеводорода при н.у. равна 0,00116 г. К какому гомологическому ряду он относится?
9-14. Органическое вещество массой 1,875 г занимает объем 1 л (н.у.). При сжигании 4,2 г этого вещества образуется 13,2 г СО2 и 5,4 г воды. Определите молекулярную формулу вещества.
9-15. При сжигании 1 моль предельного углеводорода образуется 22,4 л углекислого газа (н.у.) и 36 г воды. Найдите молекулярную формулу этого соединения и рассчитайте, какой объем воздуха потребуется для полного сгорания 1л этого газа.
9-16.Для установления формулы газообразного углеводорода 5 мл его смешали с 12 мл О2, и смесь была взорвана. После конденсации водяных паров объем газообразного остатка СО2 + О2 равнялся 7 мл, а после обработки его щелочью для поглощения СО2 осталось 2 мл газа. Найти формулу углеводорода.
9-17.При взрыве смеси 8 мл газообразного углеводорода с 36 мл О2 образовалось 16 мл СО2 и некоторое количество водяных паров. После взрыва не прореагировало 8 мл О2. Найти формулу газообразного углеводорода.
9-18. Определите простейшую формулу газа, на сжигание 1 л которого израсходовано 2 л кислорода, причем образовалось 1 л углекислого газа и 2 л водяных паров (н.у.).
9-19. Углекислый газ, образующийся при полном сгорании 0,1 моль алкана, при пропускании в избыток известковой воды дает 60 г белого осадка. Что это за алкан?
9-20. Какой газ находится в цилиндре, если известно, что он гомолог этилена и для полного сгорания 60 см3 этого газа требуется 270 см3 кислорода (н.у.)?
9-21. Для сжигания алкана объемом 20,0 л потребовался кислород объемом 160 л (н.у.). Установите, какой алкан вступил в реакцию.
9-22. Для сжигания порции алкана, содержащей 1∙1023 молекул, требуется порция кислорода, содержащая 1,6∙1024 атомов. Установите состав и возможное строение (все изомеры) алкана.
9-23.Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г СО2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду – 22,5. Определить молекулярную формулу вещества.
9-24. При сгорании 9 г предельного вторичного амина выделилось 2,24 л азота и 8,96 л углекислого газа. Определите молекулярную формулу амина.
9-25. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204∙1022 молекул.
9-26. При сжигания 6,45 г газообразного галогеналкана образовалось 4,48 л углекислого газа и 2,24 л хлороводорода (н.у.); плотность неизвестного вещества при н.у. равна 2,879 г/л. Выведите молекулярную формулу вещества.
9-27. При сгорании газообразного органического вещества выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества, рассчитайте его массу и приведите одно из возможных его названий.
9-28. При сгорании бескислородного органического вещества выделилось 4,48 л (н.у.) CO2, 3,6 г H2O и 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего соединения, рассчитайте его объем и массу.
9-29. При полном сгорании органического вещества выделилось 8,96 л (н.у.) углекислого газа, 3,6 г воды, 14,6 г хлороводорода. Установите молекулярную формулу и возможное название сгоревшего вещества, рассчитайте его массу.
9-30. При полном сгорании газообразного органического вещества, не содержащего кислород, выделилось 4,48 л (н.у.) углекислого газа, 1,8 л воды и 4 г фтороводорода. Установите молекулярную формулу сгоревшего соединения, рассчитайте его объем и массу.
9-31. При сгорании газообразного органического вещества, не содержащего кислорода, выделилось 13,2 г углекислого газа, 5,4 г воды и 2 г фтороводорода. Установите молекулярную формулу сгоревшего соединения, рассчитайте его объем и массу.
9-32. Какова структурная формула предельной одноосновной кислоты, если объем CO2, образующегося при сжигании некоторого ее количества, в три раза больше объема CO2, выделившегося при действии на такое же количество данной кислоты избытка водного раствора гидрокарбоната натрия?
9-33. Полученную при сжигании 1.5 г аминокислоты в кислороде смесь газов пропускают через трубку с фосфорным ангидридом, а затем через известковую воду. Далее поглощают кислород и измеряют объем оставшегося газа. Какова формула аминокислоты, если масса Р2О5 после пропускания газов увеличилась на 0,9 г, масса осадка, выпавшего в известковой воде -4 г, объем оставшегося после поглощения кислорода газа — 224 мл.
9-34. При сжигании 5.76 г вещества образовалось 2,12 г Na2CO3 и 5,824 л СО2 (н.у.) и 1,8 г воды. Определить формулу вещества.
9-35.При полном сгорании 3,76 г органического бромсодержащего вещества получилось 1.76 г СО2 и 0,72 г воды. После поглощения всего брома, содержащегося в данном количестве вещества, в бромистое серебро, получено 7,52 г осадка. Относительная плотность паров вещества по водороду равна 94. Определить молекулярную формулу вещества.
9-36.При сжигании 12.6 г вещества образовалось 3,18 г Na2 CO3, 4,14 г К2 CO3, 4,032 л СО2 и 2,16г Н2О. Определить молекулярную формулу вещества.
9-37. При сжигании 5,34 г орг. вещества в избытке кислорода образовалось 3,78 г воды и 5,376 л (н.у) газовой смеси, объём которой при пропускании через избыток раствора щелочи уменьшился до 1,344 л (н.у). Предложите структурную формулу вещества, если известно, что оно содержит С, Н,О,N. Плотность по водороду оставшейся газовой смеси равна 15,00.
9-38. В состав вещества входят C H O S. При сжигании его навески массой 0,222 г были получены 0,396 г СО2, 0,162 г Н2О, а сера переведена в сульфат бария массой 0,3495г. Относительная плотность паров вещества по водороду равна 74. Определить истинную формулу вещества
9-39. 54 г амина сожгли в избытке кислорода. Полученную газовую смесь после удаления О2 пропустили через раствор КОН с массовой долей 20%. Объём газа, не поглощенного щелочью, составил 13,44 л (н.у). Определите формулу амина.
1.23 (3) Относительная плотность паров органического соединения по водороду равна 22. При сжигании 4,4 г этого вещества образуется 13,2 г диоксида углерода и 7,2 г воды. Выведите молекулярную формулу органического соединения.
1.24 (3) Относительная плотность паров органического соединения по хлору равна 2. При сжигании 2,84 г этого вещества образуется 4,48 л оксида углерода (IV) (н. у.) и 3,96 г воды. Выведите молекулярную формулу этого соединения.
1.25 (3) В некоторых условиях масса некоторого объема воздуха равна 0,369 г, а масса такого же объема углеводорода — 0,738 г. Определите формулу углеводорода, если известно, что при его пропускании через водный раствор брома изменения цвета раствора не происходит.
1.26 (3) К 80 мл газообразного углеводорода добавили избыток кислорода (500 мл) и подожгли. После приведения паров к н. у. объем их составил 340 мл, а после пропускания через избыток раствора гидроксида натрия объем уменьшился до 100 мл. Определите молекулярную формулу углеводорода.
1.27 (3) При сжигании 400 см3 предельного углеводорода образовалось 400 см3 углекислого газа. Определите молекулярную формулу углеводорода.
1.28 (3) При сжигании хлоропроизводного предельного углеводорода образовалось 1,344 л углекислого газа (н. у.) и 1,08 г воды, а из хлора, содержащегося в этой навеске исходного вещества, было получено 17,22 г хлорида серебра. Плотность паров вещества по гелию 42,5. Определите молекулярную формулу вещества.
1.29 (3) 448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
2.11 (3) 7,5 г органического соединения при нормальных условиях занимает объем 4 л. При сжигании 2,1 г этого соединения образуется 6,6 г углекислого газа и 2,7 г воды. Выведите молекулярную формулу органического соединения.
2.12 (3) Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
3.16 Относительная плотность паров органического соединения по воздуху равна 4,83. При сжигании 17,5 г этого соединения получен углекислый газ объемом 28 л и воду массой 22,5 г. Выведите молекулярную формулу органического соединения.
4.14 (3) Относительная плотность паров органического вещества по кислороду равна 2,125. При сжигании 10,2 г этого вещества образовалось 16,8 л диоксида углерода (н. у.) и 10,8 г воды. Выведите молекулярную формулу этого вещества.
4.15 (3) Относительная плотность паров органического вещества по водороду равна 48. При сжигании 2,4 г этого вещества образовалось 3,92 л углекислого газа (н. у.) и 2,7 г воды. Выведите молекулярную формулу алкадиена.
5.17 (3) 27 г органического вещества при н.у. занимают объем 11,2 л. При сжигании 21,6 г этого вещества образуется 35,84 л углекислого газа и 21,6 г воды. Выведите молекулярную формулу органического вещества.
5.18 (3) Плотность паров органического соединения по неону равна 4,1. При сжигании 8,2 г этого вещества образуется 26,4 г оксида углерода (IV) и 9 г воды. Выведите молекулярную формулу органического вещества.
5.19 (3) Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
5.20 (3) При сгорании навески некоторого углеводорода плотностью по воздуху 1,38 образовалось 966 мл углекислого газа и 644 мл воды. Установите формулу углеводорода.
6.18 (3) Относительная плотность паров органического вещества по кислороду равна 2,44. При сгорании 3,9 г этого вещества образуется 13,2 г углекислого газа и 2,7 г воды. Выведите молекулярную формулу органического вещества.
7.21 (3) Относительная плотность паров органического соединения по гелию равна 25,5. При сжигании 15,3 г этого вещества образовалось 20,16 л (н.у.) углекислого газа и 18,9 г воды. Выведите молекулярную формулу органического соединения.
7.22 (3) Относительная плотность паров органического соединения по воздуху равна 4. При сжигании 14,5 г этого вещества образуется 38,5 г оксида углерода (IV) и 18 г воды. Выведите молекулярную формулу органического соединения.
7.23 (3) В результате сгорания 0,828 г органического соединения образовалось 1,584 г углекислого газа и 0,972 г воды. Относительная плотность паров этого соединения по метану 2,875. Установите формулу этого соединения и вычислите объем воздуха (н.у.), необходимого для полного сгорания 13,8 г этого вещества.
7.24 (3) При полном окислении 20,4 г органического вещества было получено 15,9 г карбоната натрия, 19,8 г углекислого газа и 13,5 г воды. Выведите молекулярную формулу органического вещества.
8.11 (3) Относительная плотность паров органического вещества по водороду равна 45. При сжигании 10,6 г этого вещества образовалось 8,96 л углекислого газа (н.у.) и 9 г воды. Выведите молекулярную формулу органического вещества.
8.12 (3) Относительная плотность паров органического вещества по кислороду равна 4,25. При сжигании 47,6 г этого вещества образовалось 77 г оксида углерода (IV) и 37,8 г воды. Выведите молекулярную формулу органического вещества.
9.7 (3) Относительная плотность паров органического соединения по водороду равна 47. При сжигании 14,1 г этого вещества образуется 39,6 г углекислого газа и 8,1 г воды. Выведите молекулярную формулу этого соединения.
9.8 (3) Относительная плотность паров органического соединения по кислороду равна 3,875. При сжигании 12,4 г этого вещества образуется 15,68 л углекислого газа (н. у.) и 7,2 г воды. Выведите молекулярную формулу этого соединения.
10.18 (3) Относительная плотность паров органического соединения по азоту равна 3,071. При сжигании 8,6 г этого вещества образуется 11,2 л углекислого газа и 9 мл воды (н.у.). Выведите молекулярную формулу этого соединения.
10.19 (3) Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н. у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
11.18 (3) Относительная плотность паров органического соединения по гелию равна 15. При сжигании 18 г этого соединения образуется 26,4 г оксида углерода (IV) и 10,8 г воды. Выведите молекулярную формулу органического соединения.
11.19 (3) При прокаливании на воздухе из 0,395 г некоторого вещества получили 0,140 г оксида кальция, из 0,948 г этого же вещества — 537,6 мл (н.у) СО2, а из 0,869 г вещества — 0,297 г Н2О. Найдите формулу соединения.
11.20 (3) При полном окислении 4,8 г органического вещества было получено 2,8 л оксида углерода (IV) (н. у.), 2,25 г воды и 2,65 г карбоната натрия. Установите формулу вещества.
12.11 (3) При полном сгорании 5,4 г некоторого органического соединения, относительная молекулярная масса которого равна 180, образовалось 4,032 л (н.у.) углекислого газа и 3,24 г воды. Определите молекулярную формулу этого соединения и предложите возможные структуры.
13.11 (3) Для сгорания 6 молей вещества потребовалось 13,5 моля кислорода и образовалось 6 молей углекислого газа, 3 моля азота и 15 молей воды. Установите молекулярную формулу вещества,
13.16 (3) Относительная плотность паров органического соединения по водороду равна 43,5. При сгорании 17,4 г этого вещества образуется 44 г углекислого газа, 2,24 л азота (н. у.) и 23,4 г воды. Выведите молекулярную формулу органического соединения.
13.17 (3) Относительная плотность паров органического соединения по этану равна 1,5. При сгорании 9 г этого вещества образуется 8,96 л углекислого газа, 12,6 г воды и 2,24 л азота и 11,7 мл воды (н.у.). Выведите молекулярную формулу органического соединения.
22. На полное сгорание 0,2 моль алкена израсходовано 26,88 л кислорода (н.у.). Установите название, молекулярную и структурную формулу вещества.
Решение: 0,2моль 26,88л
СnH2n + О2— СО2+Н2О
1моль хл
1.v(О2) =? х = 134,4л
2. γ (О2)-? =6моль или γ (О2)-? =>
. γСnH2n: . γ (О2) = 0,2 : 1,2 = 1:6
отсюда на 1 моль СnH2n надо 6 моль О2.
СnH2n + О2. = nСО2 + nН2О
3. γ (О2)-. в левой части известно — 12 атомов, а в правой — в СО2 2n и в — Н2Оn, отсюда 2n+n=12; Зn=12; n=4; С4Н8; С-С-С=С; С-С=С-С; С-С=С
С
Н3С СН3 Н3С Н
С=С С=С
Н Н Н СН3
II способ: СnH2n + О2. + nСО2 + nН2О
=6; Зn=12; n=4; С4Н8
23. При полном сжигании вещества, не содержащего (О), образуется азот и вода. D(NxHу)Н2=16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите общую формулу соединения и истинную формулу вещества.
NxHу + O2 → N2 + H2O; Мr (NxHу) = 16 2=32. Так какV(О2) = V(N2) => количество (О2) = количеству(N2)
Так как (O) в левой части 2 атома, то перед водой в схеме уравнения запишем
коэффициент 2. Тогда количество (Н) будет в 2 раза больше количества атомов (N). Если количества атомов (N). выразим через х, то количество (Н) =2х. Составим алгебраическое выражение.
NxHу = 32. Аr (N)= 14. Аr(Н)=1 => 14х+2х=32; 16х=32; х=2); => N2H4
24. Найти простейшую формулу оксида ванадия зная, что в оксиде массой 2,73г содержится, 1,53 г метала.
Дано: Решение:
m (vxoу)=2,73г т экв. (О)=16/2 = 8;
m (v)=1,53г т(О) =2,73- 1,53 = 1,2
Vx Oу=? тэкв(V) =
Ar(V) = 51 B(V) =
Или: т (О) =2,73 – 1,53 = 1,2; х : у = = 0,03 : 0,075 = 1 : 2,5 =2 : 5=>V2O5
25. Объем СО2, выделившегося при сжигании предельного одноатомного спирта, в 8 раз превосходит объем водорода, выделившегося при действии избытка натрия на такое же количество спирта. Установите строение спирта, если известно, что при его окислении образуется кетон.
Решение:
СnH2n+2О + О2. = nСО2 + n+1Н2О (1)
2СnH2n+1ОН + 2Na = H2 + 2 СnH2n+1ONa (2)
1 моль H2 из 2-х моль спирта 8 моль СО2 должно приходиться на то же количество спирта, следовательно 1 моль спирта при горении дает 4 моль СО2, =>
nСО2 = 4(1 уравнение). n ( Н2О) = n+1 = 5; n (O2) = 6.
СnH2n+2О + 6О2. = 4СО2 + 5Н2О, т. к. СО2 из 1 моль, следовательно в спирте 4 атома углерода. т. е. С4НI0О; Н3С-НCOH-СН2-СН3
26. Из I,16 г предельного углеводорода получили 1,85 г монохлорпроизводного. Определите молекулярную формулу предельного углеводорода.
Решение:
1.16 1.85
СnH2n+2 + С12 = СnH2n+1СI + НСI
14n+2 14n+1+З5.5
1,16(14n+ 36.5)=(14n+2) 1,85= 16,24n+42,34 = 25,9n+3,7
следовательно, n=4, значит С4Н10
II способ через массу приращения (.∆m)
СnH2n+1СI стал тяжелее, чем СnH2n+2 на m(С1) и меньше на m(Н).
1.16 1.85
СnH2n+2 + С12 = СnH2n+1СI + НСI
71
1) ∆m по задаче. =. 1,85-1,16=0,65; ∆m по уравнению 35,5(С1)-1(Н)=34.5.
2) mСI2-? ∆ mЗ4,5г—-7IгС12
∆ m0,65г — х гСI2 х = 1,42
3)Мг(СnH2n+2)-?
x = 62; СnH2n+2 = 62; 14n+2 = 62; 14n = 60; n = 4, значит С4Н10
III Способ;
∆m 0,65 1,16 СnH2n+2 x =62
∆m 34,5——-x СnH2n+2
СnH2n+2 = 62; 14n+2 = 62; 14n = 60; n = 4, значит С4Н10
27. Из I,74 г предельного углеводорода получили 4,11г монобромпроизводного. Определите молекулярную формулу предельного углеводорода.
1,74 4,11
СnH2n+2 + Br2 = СnH2n+1Br + НBr
14n+2 14n+1+80
I,74 (14n+81) = (14n+2) 4,11
24,36n+140,94= 57,54n+8,22
132,72= 33,18n; n=4. следовательно, С4Н10
28.При гидрогалогенировании одинакового количества алкена получили 7,85 г хлорпроизводного и 12,3 г бромопроизводного. Вывести формулу а
Решение: 7.85 12.3
Количество алкена одинаково, следовательно, n(СnH2n+1СI) = n(СnH2n+1Br)
14n+36.5 14n+81
Тогда =.> n=3.
Или через массу прирощения;
1) ∆m зад. 12,3-7,85 = 4,5
2) ∆m у-я 81(HВr) – 36,5(НСI)=44,5
СnH2n + НСI = СnH2n+1СI
3) Мг-? ∆m 4,45 — 7,85 г СnH2n+1СI
∆ m44,5——хг СnH2n+1СI х=78,5
4) n-? СnH2n+1СI = 78,5; 14n+1+35,5=78,5; n=3
5) СnH2n + HBr = СnH2n+1Br
Мг -? ∆m 4,45 г —— 12,3 СnH2n+1Br х = 123
∆m44,5г———-х СnH2n+1Br
6) n —? СnH2n+1Br = 123; I4n+1+80=123; n=3, следовательно, С3Н6
29. Определите формулу одноатомного спирта ω(С) и ω(Н) = 60% и 13,3%. Если при взаимодействии с кислотой образуется вещество, относительная плотность которого по H2 = 58.
Решение:При взаимодействии спирта и кислоты образуется сложный эфир(СnH2nО2)
1)Мг (СnH2nО2) = 58 2=116;
2)n=? (СnH2nО2) = 116; 14n+32=116; n=6. следовательно, С6H12O2.
3) (СnH2n+2О) спирт (СxНуО,) %(O)= 100 — (60+13.3) = 26,7
Х : у : z = = 5:13,3:1,67= 2,99 : 7,96 : 1=3 : 8 : 1, следовательно С3Н8О3.
30. Массовая доля «О» в одноатомном предельном спирте = 26,67%. Выведите химическую формулу вещества.
Решение.
ω% =; 26,67% = 100%;
1600 = 373n +480; n = 3 =>C3H7OH;
II Способ:
х = :60; СnH2n+2О = 60; 14n+18 = 60; 14n = 47; n = 3.
31.На сгорание одноатомного предельного спирта потребовалось 84л. Кислорода (н.у.). В результате реакции получилось СО2 и 60г. водяных паров. Определите молекулярную формулу исходного спирта.
Решение:
СnH2n+2О + О2 = n СО2 + (n+1)H2O
- γ(О2) = = 3,75 моль.
- γ(Н2О) = = 3,33г
3); 3,75(n+1) = 3,33 ; 3,75n + 3,75 =
3,75n + 3,75 = 5n; 3,75 = 1,25n; n = 3 =>C3H7OH;
32. Определите формулу ацетиленового углеводорода, если малярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса углеводорода.
Решение:
CnH2n-2 +2HBr = CnH2nBr2
Мr(CnH2n-2)< в 4 раза Мr(CnH2n-Br2)
= 4; =4; 12n+2n +160= (12n+2n-2) 4 =
14n+160 = 56n -8; 42n = 168; n = 4=>C4H8
33.10л. смеси алкена с избытком водорода (н.у.) пропустили над катализатором. Объём смеси уменьшился до 7,2л.. При пропускании той же смеси через избыток бромной воды масса склянки увеличилась на 5,25г. Определите состав смеси.
СnH2n + Н2 = СnH2n+2 СnH2n + Br2 = СnH2nBr2
- т.к. Н2 в избытке => весь алкен прореагировал.
Т.к. γ (СnH2n) = γ (Н2) => V (СnH2n) = V(Н2)
Объём уменьшился за счёт удаления водорода
- V (СnH2n) = V (Н2) = 10 – 7,2 = 2,8л.
- Т.к. бром в избытке => весь алкен прореагировал, склянка увеличилась за счёт алкена
- m 1 моль =?
; х=42; СnH2n = 42; 14n=42; n=3;=> C3H6
5)φ%(СnH2n) =?
φ%(СnH2n) = 100; φ(Н2) = 100-28=72%;
34.Смесь 3-х мл. газообразного углеводорода и 10мл. О2 взорвали. После приведения условий к первоначальным и конденсации паров воды объём смеси газов составил 8,5 мл. После пропускания полученной смеси через избыток щёлочи объём её уменьшился до 2,5мл., оставшийся газ поддерживает горение. Определите формулу взорванного углеводорода.
3мл. 10мл.
СхHу + О2 = СО2 + Н2О; СО2 + 2NaOH = Na2CO3 + Н2О;
1)Рассчитаем объём О2 вступившего в реакцию; т. к 25мл. осталось =>
10-2,5=7,5; γ(О2) = =0,335ммоль
2)Т.к. из 8,5мл. 2,5 осталось => V(СО2)=8,5-2,5=6мл; γ(СО2)= =0,268ммоль
3) γ (СхHу) =?
γ(СхHу) ==0,134ммоль; γ (СхHу): γ(О2): γ(СО2) = 0,134:0,335:0268=1:2,5:2=2:5:4;
2СхHу + 5О2 = 4СО2 + 2Н2О; γ(С): γ(Н) = 4:4, но т.к. СхHу 2 моль =>С2Н2
35.При разложении 1,68 г неизвестного карбоната получилось 0,8г углекислого газа, какой это карбонат?
1,68 г 0,8г
Мех (СО3)у→ СО2 + МехОу
44г
1)γ(СО2) = γ(СО32-); γ(СО2) = = 0,02моль => γ(СО32-); =0,02моль; М (СО32-) = 60
2)Рассчитаем массу СО32- в количестве 0,02моль
3) Рассчитаем массу М (Мех(СО3)У); х=84;
4)m(Ме) =84- (1,2 + 48)= 24; Аr(Me) =24 =>это Mg
36 Вывести химическую формулу вещества если, ω% (Mg) =20%; ω%(О)=53,33%; , ω%(Э)=26,67%.
1)√ (Mg)=?=0,83моль; 2) √(О)==3,33моль; Mg ЭО4MgхЭуОz
100%
20%
3)X:Z=0, 83:3, 33=1:4 => Mg ЭО4
4) Мr (Mg ЭО4) =? x=120
5) m (Э)=120-(24+64)=32; Аr(Э)=32 =>S; Mg SО4
37.При обработке предельного одноатомного спирта натрием получено 2,24л водорода (н.у.), а при дегидратации такой же порции спирта получено 11,2г алкена. Определите состав спирта.
2,24л
2СnH2n+1ОН + 2Na = H2 + 2 СnH2n+1ONa
11,2г
СnH2n+1ОН→ СnH2n+ Н2О
1) √( H2)=? =0,1моль; 2) √(СnH2n+1ОН): √(H2): √(СnH2n ) =2:1:2; 3)т.к. √( H2)=0,1моль =>√(СnH2n ) =0,2моль; рассчитаем массу 1 моль алкена; m=? ; СnH2n=56; 14n=56; n=4; С4H8О;
Или:
2,24л 11,2г
СnH2n+1ОН→ H2 → СnH2n х=112;
22,4л х
Это 2 моль=> m 1моль=112/ 2=56 и т.д.
38.Сложный эфир массой 30г. Подвергнут щелочному гидролизу. При этом получено 34г. Натриевой соли предельной одноосновной кислоты и 16 г. Спирта. Установите молекулярную формулу этого эфира.
30г Хг 34г. 16г
СnH2n О2 + NaОН→ СnH2n-1 О2Na + СnH2n+1ОН
14n+32 40г
По закону сохранения масс веществ масса левой части уравнения равна массе правой части. Отсюда, если от суммы масс правой части отнимем массу эфира, мы получим массу NaОН вступившего в реакцию.
m(NaОН) = (34+16) – 30 = 20
30г 20
СnH2n О2 + NaОН→ СnH2n-1 О2Na + СnH2n+1ОН
14n+32 40г
; формула эфира: С2Н4О2
39.Установите молекулярную формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77% кальция
69,23% 30,77%
2 СnH2nО2 + Са = ( СnH2n-1О2)2Са + H2
14n-1+32 40
ω% =; 30.77% = 100%;
(28n +102) 30,77 =4000; 861,56n =861.46; n =1; Формула кислоты СН2О2— мурвьинная кислота
Или можно по другому:
Или можно по другому: Сначала рассчитаем молекулярную массу.
( СnH2n-1О2)2Са = 130; 28n +102 =130; n =1; Формула кислоты СН2О2— муравьиная кислота
40. Установите формулу предельной одноосновной кислоты натриевая соль которой содержит 33,82% натрия.
66,18% 33,82%
2 СnH2nО2 + 2Na = 2СnH2n-1О2Nа + H2
14n-1+32 23
ω% =; 33,82% = 100%; 33,82% =
23=4,7348n + 18,2628; 4,7372=4,7348n; n =1; Формула кислоты СН2О2— муравьиная кислота
Или:
33,82% = 0,3382Х=23; Х=68; СnH2n-1О2Nа=68; 14n+54=68; 14n=14; n=1.
41.При сгорании 1г одноатомного спирта выделился углекислый газ объёмом 1,12л.. Установите молекулярную формулу этого спирта
1г 1,12л
СnH2n+2О + О2 = nСО2 + (n+1)H2O
14+2+16 n22.4л
; Формула спирта: С3Н8О или С3Н7ОН
42.При взаимодействии 23г. предельного одноатомного спирта с концентрированной серной кислотой образуется газ. При взаимодействии этого газа с 11,2л водорода(н.у.) образуется алкан. Установите молекулярную формулу алкана.
23г
СnH2n+1ОН → кат. СnH2n + Н2О
11,2л
СnH2n + H2 → кат. CnH2n+2; νспирта :νалкена = 1:1, νН2 : ν алкена =1 : 1;
22,4л
Отсюда рассчитав количество Н2 мы будем знать количества всех веществ в реакции.
ν(Н2 ) = V/Vm; ν(Н2 ) = 11,2л / 22,4л/моль = 0,5 моль. Отсюда следует, что спирта в реакцию вступило тоже 0,5моль.
Рассчитаем молярную массу спирта.
Mr(СnH2n+1ОН) = m/ν; Mr(СnH2n+1ОН) = 23г/0,5моль = 46г/моль;
СnH2n+1ОН =46; 14n+18 =46; 14n =28; n = 2; Формула алкана: С2Н6
43. Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
|
Дано: |
1)Определяем простейшую формулу соединения: n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1 2)Находим молярную массу соединения: M= (0, 51 · 8,31 · 280)/(98,64 ·103·118 ·10-6) = =101,95 г/моль. 3)М (S F) = 51 101,95: 51 = 2 Следовательно, формула соединения S2 F2 Ответ: S2F2 |
|
Вывести формулу соединения |
44. Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
1)СnН2n-2 + 2НВr → СnН2nВr2 ;
2) рассчитана молярная масса углеводорода и продукта реакции:
М(Сn Н2n-2) = 14n – 2; М(Сn Н2nВr2) = 14n + 160;
3) установлена молекулярная формула углеводорода:
(14n + 160)/(14n – 2) = 4, n = 4;
Формула: С4Н6.
45. При сжигании 3 л газообразного углеводорода получено 6 л углекислого газа и некоторое количество воды. Определите молекулярную формулу углеводорода, если известно, что для полного сжигания потребовалось 10,5 л кислорода.
СхНу + О2 = СО2 + Н2О
ν(СхНу) :ν(О2) : ν(СО2) = = 0,134:0,469:0,268+1:3,5:2/2=2:7:4; тогда
2СхНу + 7О2 = 4СО2 + Н2О;
ν(СО2)= ν(С) тогда ν(С)=4; 4 атома приходится на 2 моль СхНу, тогда в 1 моль 2 атома углерода.
2СхНу + 7О2 = 4СО2 + 6Н2О;
ν(Н) в 6Н2О =12 атомов, следовательно в 2-х моль СхНу ν(Н) =12 атомов, а в 1 моль 6 атомов. Отсюда формула С2Н6-этан.
ν(О2) 7 моль, т.е. 14 атомов, в(СО2) кислорода 8 атомов, тогда в Н2О ν (О)= 14-8=6
46. Определите молекулярную формулу алкана, если известно, что для его сжигания потребовалось 10 л кислорода и при этом образовалось 6 л углекислого газа.
СnH2n+2 +О2= nСО2 + n+1Н2О
ν(О2) =: ν(СО2) =
Или: .
Ответ:С3H6
Определение формулы вещества по известной общей формуле и массовой доле одного из элементов.
47. Установите молекулярную формулу предельного трёхатомного спирта, массовая доля водорода в котором равна 10%.
|
Дано: CnH2n+2 O3 W(H) =10%=0,10 |
Решение Формула C5H12 O3 |
|
n=? |
48. Монобромпроизводное алкана содержит 35% углерода по массе. Определите молекулярную формулу этого соединения.
|
Дано: CnH2n+1Br W(C) =35%=0,35 |
Решение Формула C4H9Br |
|
n=? |
49. Монохлоралкан содержит 70,3% хлора по массе. Установите молекулярную формулу этого соединения.
50.Один из монобромалканов содержит 65,04% брома. Установите молекулярную формулу этого соединения.
51. Установите молекулярную формулу предельного двухатомного спирта, массовая доля водорода в котором равна 10,53%.
|
Дано: CnH2n+2 O2 W(H) =10,53%=0,1053 |
Решение Формула C3H8 O2 |
|
n=? |
52. Установите молекулярную формулу предельного двухатомного спирта, массовая доля водорода в котором равна 11,11%.
53. Установите молекулярную формулу предельного двухатомного спирта, массовая доля углерода в котором равна 47,37%.
|
Дано: CnH2n+2 O2 W(С) =47,37%=0,4737 |
Решение Формула C3H8 O2 |
|
n=? |
54. Установите молекулярную формулу предельного трёхатомного спирта, массовая доля водорода в котором равна 9,43%.
55. Установите молекулярную формулу предельного трёхатомного спирта, массовая доля кислорода в котором равна 45,28%.
|
Дано: CnH2n+2 O3 W(О) =45,28%=0,4528 |
Решение Формула C4H10 O3 |
|
n=? |
56. Массовая доля кислорода в одноосновной карбоновой кислоте равна 43,24%. Установите молекулярную формулу кислоты.
|
Дано: CnH2n O2 W(О) =43,24%=0,4324 |
Решение Формула C3H6 O2 |
|
n=? |
57. Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
Определение формулы вещества по его реакционной способности.
58. При нагревании 120г предельного одноатомного спирта в присутствии концентрированной серной кислоты было получено 84г алкена. Установите формулу исходного спирта.
|
120г |
84г |
||
|
CnH2n+2 O |
→ |
CnH2n |
+ H2О |
|
14n+2+16 |
12n+2n |
120×14n=84(14n+18); 1680n=1176n+1512; 504n=1512; n=3;
Формула C3H8 O, или C3H7 OН
59. При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85г хлорпроизводного или 12,3г бромпроизводного. Определите молекулярную формулу алкена, запишите его название и структурную формулу.
60. Ацетиленовый углеводород может максимально присоединить 80г брома с образованием продукта реакции массой 97г. Установите молекулярную формулу этого углеводорода.
|
80 |
97 |
||
|
CnH2n-2 |
+2Br2 |
→ |
CnH2nBr4 |
|
320 |
14n+320 |
; 80(14n+320)=97×320; 1120n + 25600 = 31040; 1120n =5440; n = 5;
Формула вещества: C5H8
61. В результате реакции предельного одноатомного спирта с хлороводородом массой 18,25 получили органический продукт массой 46,25г и воду. Определите молекулярную формулу исходного спирта.
62. На нейтрализацию 18,5г одноосновной карбоновой кислоты потребовался раствор, содержащий 10г гидроксида натрия. Определите молекулярную формулу исходной кислоты.
63. На нейтрализацию 25,5г одноосновной карбоновой кислоты потребовался раствор, содержащий 10г гидроксида натрия. Определите молекулярную формулу исходной кислоты.
64. Предельный одноатомный спирт обработали металлическим натрием. В результате реакции получили вещество массой 20,5г и выделился газ объёмом 2,8 л (н.у.). Определите молекулярную формулу исходного спирта.
65. При взаимодействии 30г предельного одноатомного спирта с металлическим натрием выделилось 5,6л (н.у.) газа. Определите молекулярную формулу исходного спирта.
66. При взаимодействии 23г предельного одноатомного спирта с металлическим натрием выделилось 5,6л (н.у.) газа. Определите молекулярную формулу исходного спирта.
67. При взаимодействии 22г предельной одноатомной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6л(н.у.) газа. Определите молекулярную формулу исходной кислоты.
68. Установите молекулярную формулу предельного трёхатомного спирта, массовая доля углерода в котором равна массовой доле кислорода
СnH(2n-1)(OH)3
m кислорода=16×3=48,следовательно углерода=48/12=4
C4H7(OH)3
