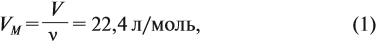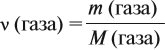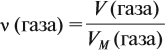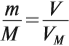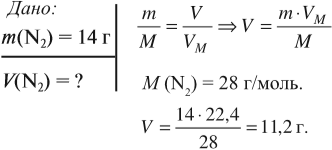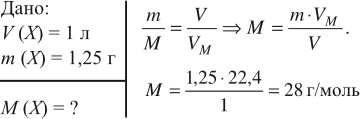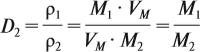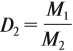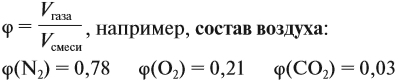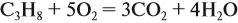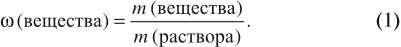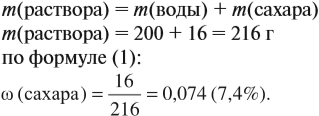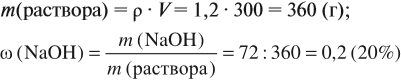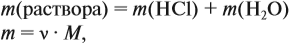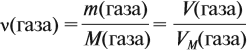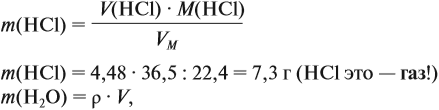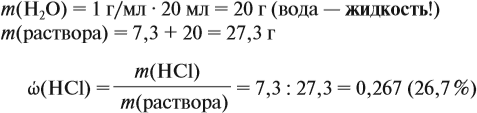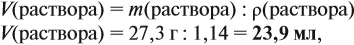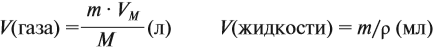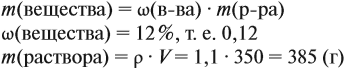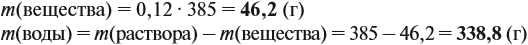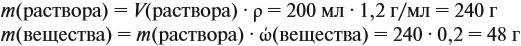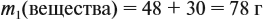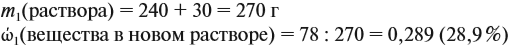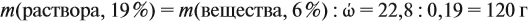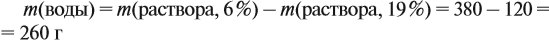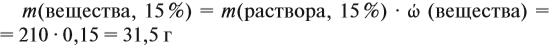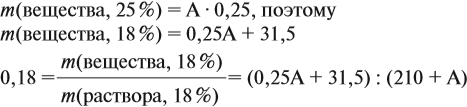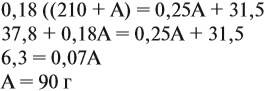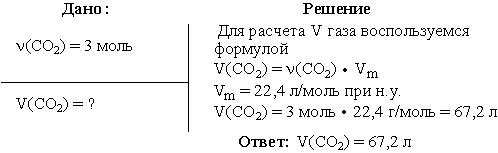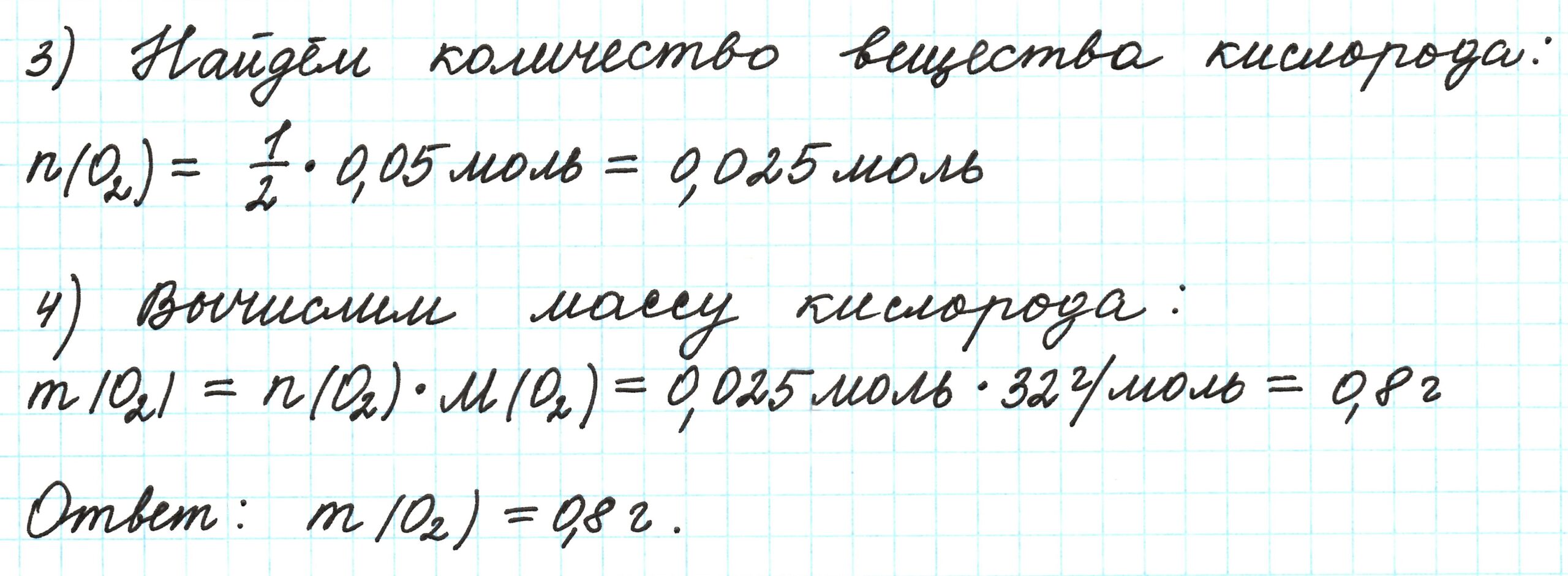В ходе решения таких задач рекомендуется придерживаться алгоритма:
- внимательно прочитать условие задачи и выяснить, что у вас спрашивают;
- написать соответствующую формулу и проанализировать её;
- найти числовые значения требуемых величин, каждый раз записывая вначале формулу, а затем расчёт, учитывая размерность величин.
Содержание
- Задачи по теме «Газы»
- Задачи для самостоятельного решения
- Задачи по теме «Способы выражения концентрации растворов»
- Задачи для самостоятельного решения
Задачи по теме «Газы»
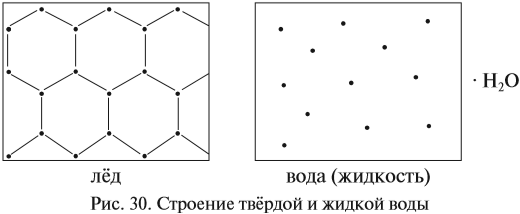
Известно, что вещества при нормальных условиях (н. у.) могут находиться в трёх агрегатных состояниях: твёрдом, жидком, газообразном. В твёрдом и жидком состояниях между молекулами (атомами) вещества имеются довольно сильные взаимодействия, в результате чего частицы находятся на небольших расстояниях друг от друга (рис. 30).
В газах расстояния между частицами очень велики, и силы взаимодействия ничтожны (рис. 31).
Поэтому равные объёмы любых газов содержат одинаковое число молекул. Это формулировка закона АВОГАДРО.
Следствием этого закона является:
1 моль любого газа при нормальных условиях (н. у.) занимает объём 22,4 литра.
Эта величина (22,4 л/моль) является молярным объёмом газа (VМ):
где VM — молярный объём газа, моль/л; V — объём газа, л; ν — количество вещества газа, моль.
Таким образом, зная массу газа, можно определить:
Но для того же газа из формулы (1) имеем:
Отсюда для любого газа выполняется соотношение:
Задача 3. Какую массу имеет кислород объёмом 7 л?
Задача 4. Какой объём занимает азот массой 14 г?
Задача 5. Чему равна молярная масса газа, 1 л которого имеет массу 1,25 г?
Ответ. Молярная масса неизвестного газа 28 г/моль.
Пользуясь этими формулами, можно рассчитать объём, массу, молярную массу газа, например:
Известно, что
где ρ — плотность газа (г/л), поэтому:
ПОМНИТЕ! Эти формулы можно использовать лишь тогда, когда данные задачи (плотность газа, его объём) измерены при н. у.: 273 К, 1 атм.
Из формулы (3) вытекает понятие об относительной плотности газов (Dx). Эта величина, равная отношению плотностей двух газов:
где ρ1 и М1 — плотность и молярная масса одного газа, а ρ2 и М2 — плотность и молярная масса другого газа.
Относительная плотность газа показывает, во сколько раз данный газ тяжелее второго газа. Пользуясь этой формулой, можно легко определить молярную массу данного газа:
Выполняя такие расчёты, следует помнить, что:
- любая смесь газов, например воздух, именуется в задачах словом «газ»;
- средняя молярная масса воздуха, как показывают расчёты, равна 29 г/моль;
- по умолчанию, если не сказано иного, расчёты ведут для н. у.: 273 К, 1 атм.
Задача 6. Определить молярную массу газа, если:
а) плотность его равна 1,25 г/л;
б) плотность его по кислороду равна 0,75.
Решение.
Состав смеси газов, как правило, измеряют в объёмных процентах φ (фи).
Второе следствие, при помощи которого была экспериментально подтверждена гипотеза Авогадро (гипотеза стала законом уже после смерти автора!), заключается в следующем: объемы реагирующих газов относятся как их коэффициенты в соответствующем уравнении реакции.
Это следствие позволяет решать задачи «в уме», если известны объёмы реагирующих газов или количества вещества для них.
Задача 7. Какой объём кислорода потребуется для сжигания 6 л пропана?
Из уравнения реакции:
видно, что молярное соотношение пропана и кислорода составляет 1 : 5. Таким образом, объём кислорода в пять раз больше объёма пропана.
Ответ. Требуется 5 · 6 = 30 л кислорода.
Задачи для самостоятельного решения
3. Определить массы газов:
а) хлороводорода, объёмом 56 л;
б) озона О3, объёмом 14 л.
4. Определить объёмы газов:
а) хлороводорода, массой 72 г;
б) аммиака NH3, массой 3,4 г.
5. Определить молярные массы газов, если:
а) 2 л газа имеет массу 2,86 г;
б) 10 г газа занимает объём 7,47 л.
6. Определить молярную массу газа, если:
а) плотность его равна 1,52 г/л;
б) плотность по кислороду равна 1,81.
7. Какой объем занимает смесь, состоящая из 4 г метана и 22 г пропана?
8. Какой газ имеет большую массу: этан, объёмом 56 л или бутан, объёмом 44,8 л?
9. Существуют ли газообразные соединения серы легче воздуха?
10. Определите, не выполняя расчёт, какой из газов тяжелее воздуха: Не, Ar, CO2, CH4, N2, O2.
Задачи по теме «Способы выражения концентрации растворов»
Для того чтобы определить массовую долю растворенного вещества, нужно воспользоваться формулой:
Ответ может быть дан в долях (единицы): ω = 0,15; или в процентах: ω% = 15 %.
Задача 8. В 200 г воды растворили 16 г сахара. Определить ω(сахара) в полученном растворе.
Решение. В данном случае масса раствора неизвестна. Но:
Задача 9. В 300 мл раствора (ρ = 1,2 г/мл) содержится 72 г NаОН. Определить ω(NаОН) в этом растворе.
Решение. В этом случае масса раствора неизвестна, но известен объём. Найдём массу раствора:
Задача 10. В 20 мл воды растворили 4,48 л хлороводорода. Определить ω(НСl) в соляной кислоте. Плотность раствора равна 1,14 г/мл.
Решение. При растворении хлороводорода в воде получена соляная кислота, её масса равна:
где ν — количество вещества, моль; M — молярная масса вещества, причём для газов
откуда
где ρ — плотность воды (1 г/мл); V — объём воды, мл
Обратите внимание: в 20 мл воды растворили 4,48 л газа, но суммарный объём отнюдь не равен (4,48 + 0,02), т. е. 4,5 литра! Суммарный объём этого раствора равен:
т. е. при растворении более 4 литров газа объём жидкого раствора увеличился менее чем на 4 миллилитра!
Выводы.
- Объёмы жидкостей и объёмы растворяемых газов суммировать нельзя.
- При растворении в жидкости газы сжимаются более чем в 1000 раз.
- Объёмы жидкостей и газов рассчитывают (исходя из значения массы) по-разному:
где m — масса, г; М — молярная масса, г/моль; V — объём (жидкости в мл, газа — в л); ρ — плотность жидкости, г/мл.
Пользуясь формулой (1) нетрудно рассчитать и массу раствора, и массу растворённого вещества. Но при этом следует учитывать, что обычно в задачах говорится (упоминается) о «5 %-ном растворе», «16 %-ном растворе» и т. д., т. е. массовая доля вещества выражена в процентах. В этом случае легко видеть, что:
- в 5 %-ном растворе ω(вещества) = 0,05;
- в 16 %-ном растворе ω(вещества)= 0,16 и т. д.
Зная массовую долю вещества в растворе, можно определить:
Задача 11. Сколько граммов соли и воды нужно взять для приготовления 350 мл (ρ = 1,1 г/мл) 12 %-ного раствора?
Решение. Из формулы (1) получаем формулу (2):
где ρ — плотность раствора (1,1 г/мл); V — объём раствора (350 мл), тогда
Задача 12. Сколько граммов 8 %-ного раствора можно приготовить, имея 64 г NaCl?
Решение. Из формулы (3):
Такие задачи можно решать, составляя пропорции. При этом следует знать, что массовая доля (в %) вещества показывает, сколько граммов вещества содержится (растворено) в 100 граммах раствора: 5 %-ный раствор ⇒ 5 г вещества в 100 граммах раствора.
Задача 13. Сколько мл 15 %-ного раствора (ρ = 1,1 г/мл) можно приготовить из 22,5 г вещества?
Обратите внимание: в пропорции в одном столбце должны совпадать и размерность, и наименование компонента, о котором идёт речь.
Задача 14. К 200 мл 20 %-ного раствора (ρ = 1,2 г/мл) добавили 30 г того же вещества. Определить массовую долю вещества в полученном растворе.
Решение. Определим в начале массу исходного раствора и растворённого вещества:
При добавлении новых порций растворяемого вещества, его масса увеличивается:
На ту же величину увеличивается масса раствора:
Задача 15. Сколько граммов 19 %-ного раствора и воды нужно взять для получения 380 г 6 %-ного раствора?
Решение. При добавлении воды масса растворённого вещества не меняется. Поэтому рассчитаем массу растворённого вещества в 6 %-ном растворе (столько же его будет и в 19 %-ном растворе):
Теперь можно рассчитать массу 19 %-ного раствора:
Теперь задумаемся: почему возросла масса исходного 19 %-ного раствора? Потому, что добавили воду. Значит, масса воды равна:
Ответ. Нужно добавить 260 г воды.
В случаях, когда изменяется и масса раствора, и масса вещества, нужно прибегнуть к приёму, когда неизвестная величина (о ней спрашивается в вопросе задачи), принимается за известную, и обозначается А.
Задача 16. Сколько граммов 25 %-ного раствора нужно добавить к 210 г 15 %-ного раствора, чтобы получить 18 %-ный раствор?
Решение. Пусть нужно добавить А граммов 25 %-ного раствора, тогда масса 18 %-ного раствора составит (210 + А) г. Определим массу вещества в 15 %-ном растворе:
аналогично:
Решим полученное уравнение:
Ответ. Нужно добавить 90 г 25 %-ного раствора.
Задачи для самостоятельного решения
11. В 300 г раствора содержится 45 г поваренной соли. Определить ω (NaСl) в этом растворе.
12. В 300 мл воды растворили 100 г сахара. Определить ω (сахара) в полученном растворе.
13. В 2 л раствора (пл. = 1,05 г/мл) содержится 105 г соли. Определить ω(соли) в этом растворе.
14. В 200 мл воды растворили 56 л аммиака NH3. Определить ω (NH3) в этом растворе.
15. Бромоводород объёмом 5,4 л затрачен на приготовление 8 %-ного раствора (пл. = 1,057 г/мл). Найти объём полученного раствора.
16. Сколько граммов воды и сахара нужно взять для приготовления 3 литров 30 %-ного сиропа? (Пл. = 1,13 г/мл.)
17. Какой объём 25 %-ного раствора можно приготовить из 150 г соли, если плотность раствора равна 1,2 г/мл?
18. К 500 мл 32 %-ной кислоты (ρ = 1,2 г/мл) добавили 1 л воды. Вычислить массовую долю кислоты в полученном растворе.
19. Смешали 25 г 16 %-ного раствора КОН с 30 мл 20 %-ного раствора КОН (плотность 1,2 г/мл). Вычислить массовую долю щёлочи в полученном растворе.
20. К 220 г 20 %-ного раствора поваренной соли добавили 44 мл воды и 36 г этой же соли. Вычислить массовую долю соли в полученном растворе.
21. Определить массу воды, которую нужно выпарить из 1 кг 3 %-ного раствора сульфата меди II для получения 5 %-ного раствора.
22. Сколько граммов воды нужно добавить к 50 г 70 %-ной уксусной кислоты, чтобы получить 5 %-ный уксус?
23. После добавления соды к 200 мл 16 %-ного раствора её (ρ = 1,17 г/мл) массовая доля вещества возросла до 20 %. Определить массу добавленной соды.
24. Какой объём 96 %-ной кислоты (ρ = 1,86 г/мл) необходимо добавить к 5 л 30 %-ной кислоты (ρ = 1,3 г/мл), для того чтобы получить 40 %-ный раствор?
Вычисление массы и объема газов
Если в условиях задачи указаны вещества в газообразном состоянии, то при вычислениях необходимо использовать газовые законы, связывающие количества и массы веществ с их объемами.
Задача 1. Вычислить объем диоксида углерода при н.у., взятого количеством
вещества 3 моль.
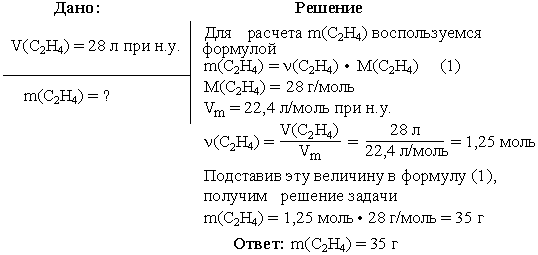
Задача 2. Вычислить массу этилена (C2H4), занимающего при н.у. объем 28 л.
Задача 3. Вычислить объемную долю метана в смеси, состоящей из 30 л
метана, 5 л этана и 2 л водорода. Объемы газов измерены при одинаковых
условиях.
Часто допускается ошибка, когда при проведении расчётов отождествляются величины массовых и объёмных долей вещества.
Чтобы показать ошибочность таких представлений, рассмотрим решение задачи, в которой расчёт объемов газов связан с вычислениями их масс.
Задача 4. Имеется газовая смесь, массовые доли газа в которой равны (%): метана – 65, водорода – 35. Определите объемные доли газов в этой смеси.
Таким образом, числовые значения массовых и объемных долей не совпадают.
Расчёты объёмных отношений газов
при химических реакциях
Элемент ЕГЭ: 4.3.3. Расчёты объёмных отношений газов при химических реакциях.
Расчёты объёмных отношений газов при химических реакциях основаны на законе Гей-Люссака (химический закон объёмных отношений). В англоязычной литературе закон Гей-Люссака обычно называют законом Шарля.
Закон Гей-Люссака — закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении (то есть в изобарном процессе), названный в честь французского физика и химика Жозефа Луи Гей-Люссака. Математически закон выражается следующим образом: V ∼ T или V/T = const, P = const, где V — объём газа, T — температура, P — давление.
Если известно состояние газа при неизменном давлении и двух разных температурах, закон может быть записан в следующей форме: V1 : T1 = V2 : T2 или V1T2 = V2T1.
В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Число атомов (в отличие от молекул) до реакции и после ее протекания остается неизменным. Это учитывается с помощью стехиометрических коэффициентов в уравнениях химических реакций.
Коэффициенты в уравнениях реакций показывают числа объемов реагирующих и образовавшихся газообразных веществ. Например: 2 объема водорода и 1 объем кислорода дают 2 объема водяного пара:
2H2 + O2 = 2H2O.
В реакции, уравнение которой 3Н2 + N2 = 2NH3, объемы реагирующих азота и водорода и объем образовавшегося аммиака связаны следующим соотношением:
V(Н2) : V(N2) : V(NH3) = 3 : 2 : 1
Однако эти соотношения выполняются только между веществами, участвующими в одной и той же химической реакции. Если реагент участвует в двух параллельных реакциях, то его количества веществ в этих реакциях никак не связаны друг с другом и могут находиться в любых соотношениях.
Следствие из закона Авогадро. При одинаковых условиях 1 моль любого газа занимает одинаковый объем. Объем газа количеством 1 моль, измеренный при н. у., называют молярным объемом и обозначают Vm. Следовательно: n = V : Vm, где V — объем газа, n — количество газа. Молярный объем газообразных веществ выражается в л/моль: Vm = 22,4 л/моль.
Обозначения: V – объем; Р – давление; Т – температура; n – количество вещества; m – масса вещества; М – молярная масса вещества; R – универсальная газовая постоянная.
R = 8,314 Дж/(К•моль) = 0,08205 л•атм/(К•моль).
Нормальные условия: 0 °С и 1,013 • 105 Па.
Нормальное давление: 1,013 • 105 Па = 1 атм = 760 мм рт. ст.
РЕШЕНИЯ ЗАДАЧ
на Расчёты объёмных отношений газов
Задача № 1.
Какой объём аммиака получится, если в реакцию синтеза вступает азот объёмом 10 м3 (объёмы всех газов измерялись при одинаковых условиях)?
Правильный ОТВЕТ: V(NH3) = 20 м3.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найдите массу 33,6 м3 аммиака NH3 при н. у.
Правильный ОТВЕТ: m(NH3) = 25,5 кг.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 3.
Как изменится объем определенного количества газа при увеличений давления от 1,013 • 105 Па до 2,026 • 105 Па (температура при этом остается постоянной)?
Правильный ОТВЕТ: уменьшится в 2 раза.
Смотреть указания к решению
Задача № 4.
Как изменится объем определенного количества газа при нагревании от 20 до 40 °С при постоянном давлении?
Правильный ОТВЕТ: увеличится в 1,07 раз.
Смотреть указания к решению
Задача № 5.
Образец газа при 0 °С и давлении 1,013 • 105 Па занимает объем 22,4 л. Какой объем он будет занимать: а) при 25 °С и 1,52 • 105 Па ; б) 50 °С и 2,53 • 105 Па; в) 100 °С и 1,013 • 106 Па ?
Правильный ОТВЕТ: а) 16,3 л; б) 10,6 л; в) 3,06 л.
Смотреть указания к решению
Задача № 6.
Водяной пар при 100 °С и давлении 1,013 • 105 Па занимает объем 200 см3. Приведите его объем к нормальным условиям.
Правильный ОТВЕТ: 146 см3
Смотреть указания к решению
Задачи с ответами
на Расчёты объёмных отношений газов
Задача № 7.
При взаимодействии серы с водой при температуре > 400 °С образовалось 2 л сероводорода. Определите объем (л) второго продукта реакции. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 1,0 л.
Задача № 8.
При сжигании сероводорода истрачено 6 л кислорода. Определите объем (л) образовавшегося диоксида серы.
Правильный ОТВЕТ: 4,0 л.
Задача № 9.
Рассчитайте объем (л) кислорода, необходимого для окисления 4 л аммиака до азота (при сжигании).
Правильный ОТВЕТ: 3,0 л.
Задача № 10.
Рассчитайте объем (л) порции аммиака, полученной взаимодействием 10,08 л водорода с избытком азота.
Правильный ОТВЕТ: 6,72 л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Расчёты объёмных отношений газов при химических реакциях». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:
Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.
Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.
Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.